
- •34. Водород. Атом и молекула водорода, изотопы водорода. Гидриды металлов и неметаллов. Водород как окислитель и восстановитель. Получение водорода в лаборатории и в промышленности.
- •36. Вода. Фазовая диаграмма воды. Физические и химические свойства. Автопротолиз. Горение водорода в кислороде. Топливные элементы.
- •37. Пероксид водорода. Окислительно-восстановительные свойства, получение и применение пероксида водорода. Пероксиды металлов.
- •39. Галогеноводороды. Физические и химические свойства (температуры кипения, сила кислот и восстановительная способность). Особенности фтороводорода. Биологическая роль галогенов.
- •40.Кислородные кислоты галогенов. Кислотно-основные и окислительные свойства оксокислот хлора. Устойчивость кислородных кислот хлора и их солей, применение солей оксокислот хлора.
- •41. Сера. Строение молекул и свойства простого вещества. Сероводород и сульфиды. Полисульфиды. Восстановительные свойства сероводорода и сульфидов, растворимость сульфидов металлов.
- •42. Оксиды серы. Получение и свойства оксидов серы (IV) и (VI). Сернистая и серная кислота, сульфиты и сульфаты. Окислительно-восстановительные свойства сульфитов и сульфатов.
- •43. Общая характеристика элементов vа группы. Свойства простых веществ. Выбор стандартного состояния фосфора. Водородные соединения элементов vа группы, сравнение их электронодонорных свойств.
- •44. Азот, аммиак
- •Билет 45. Оксиды азота
- •Билет 46. Азотная и азотистая кислота, нитраты и нитриты.Окислительно-восстановительныесв-ва нитритов и нитратов. Применение нитратов.
- •47. Кислородсодержащие кислоты фосфора. Полифосфорные кислоты, атф. Растворимость солей ортофосфорной кислоты и их гидролиз.
- •48. Углерод. Полиморфные модификации. Карбиды металлов. Оксиды углерода. Угольная кислота и ее соли. Роль карбонатов в углекислотном балансе атмосферы. “Парниковый” эффект.
- •49. Кремний. Силициды металлов. Силаны. Кремниевые кислоты и силикаты. Стекло.
- •52. Бор. Бороводороды, трехцентровые связи. Боразотные аналоги углеводородов. Борная кислота, пероксобораты.
- •57. Металлы iiв группы. Свойства простых веществ. Степени окисления, свойства гидроксидов, сульфидов. Биологическая роль соединений элементов iiв группы.
- •59. Кислоты и соли, образуемые элементами viв группы в высших степенях окисления. Сравнение кислотных и окислительных свойств.
- •Билет 60. Про марганец
- •Билет №62 Чугуний.
Билет 60. Про марганец
Марганец – элемент побочной подгруппы VII группы в короткопериодном варианте Периодической системы. К этой же группе относятся технеций Тс и рений Re. Электронная конфигурация атомов в основном состоянии (n-1)d5ns2, в частности для Mn – 3d54s2. Поэтому максимальная степень окисления +7, которая для Tc и Re наиболее устойчива. Для всех элементов характерны степени окисления +4 и +6.
Для марганца характерны +2, +3, +4, +5, +6, +7.
Простые вещества элементов VIIВ группы – серебристо-белые металлы.температуры плавления и кипения повышаются от Mn к Re, а химическая активность снижается.
Марганец в компактном виде покрывается на воздухе тонкой оксидной пленкой, которая предохраняет его от дальнейшего окисления даже при нагревании. В мелкодисперсном виде он достаточно активен с неметаллами.
Горение в кислороде: 3Mn + 2O2 = Mn3O4. Mn3O4 – смешанный оксид MnMn2O4.
С галогенами, серой и азотом дает в основном производные степени окисления +2:
Mn + Г2 = MnГ2 (Г = F, Cl. Br, I)
Mn + S = MnS
3Mn + N2 = Mn3N2
Марганец – активный металл (в ряду стандартных электродных потенциалов стоит между магнием и цинком). В виде порошка даже с водой взаимодействует:
Mn + H2О = Mn(OH)2 + H2↑
В компактном состоянии устойчив к действию воды из-за оксидной пленки.
Растворяется в разбавленных кислотах (кроме азотной) с образованием солей Mn (II), окрашенных в бледно-розовый цвет аквакомплекса [Mn(H2O)6]2+:
Mn + H2SO4 = MnSO4 + H2↑
Mn + 2HCl = MnCl2 + H2↑
Азотная кислота и концентрированная серная кислота пассивируют марганец на холоде. С растворами щелочей не реагирует.
Получение:
Для металлургии получают в виде дешевого сплава марганца с железом (ферромарганца) при восстановлении смеси оксидов MnO2 и Fe2O3 углем в доменной печи:
MnO2 + Fe2O3 + 5С = Mn + 2Fe + 5CO
Электролиз водного раствора сульфата марганца (II)
Алюмотермия: 3Mn3O4 + 8Al = 9Mn + 4Al2O3
В соединениях марганец устойчив в степенях окисления +2, +3, +4, +7.
Марганец образует следующие оксиды: MnO, Mn2O3, MnO2, MnO3 (не выделен в свободном состоянии) и марганцевый ангидрид Mn2O7.Наиболее устойчивы оксиды MnO2 и MnO4.
Степень +2 наиболее характерна. Соответствующий оксид MnO.
Образуется:
при восстановлении высших оксидов марганца водородом:
Mn3O4 + H2 = 3MnO + H2O
при термическом разложении карбоната или оксалата марганца (II) в инертной атмосфере, исключающая возможность окисления MnO:
MnCO3 = MnO + CO2 (газ)
Оксид не растворим в воде. Гидроксид Mn(OH)2 получают действием щелочи на растворимые соли марганца (II):
MnCl2 + 2NaOH = Mn(OH)2↓ + 2NaCl
Оксид и гидроксид марганца (II) проявляют основные свойства. Растворяются в кислотах:
MnO + 2 HCl = MnCl2 + H2O
Mn(OH)2 + H2SO4 (разб) = MnSO4 + 2H2O
Гидроксид медленно растворяется в концентрированных растворах щелочей, образуя гидрокомплексы:
Mn(OH)2 + 4KOH ↔ K4[Mn(OH)6]
Окисление кислородом воздуха до оксогидроксда марганца (III):
4Mn(OH)2 + O2 = 4MnO(OH) + 2H2O
Дальнейшее окисление возможно при сплавлении на воздухе со щелочью:
2 MnO2 + O2 + 4 KOH = 2 K2MnO4 + 2 H2O
Неустойчивый манганат диспропорционирует:
3 K2MnO4 + 2 H2O = 2 KMnO4 + MnO2 + 4 KOH
Другие окислители - в оксид марганца (II): Mn(OH)2 + Br2 + 2NaOH = MnO2 +2H2O+ 2NaBr
Mn2+ образует соли со всеми обычными анионами. Эти соли более устойчивы к окислению, чем Mn(OH)2. Хорошо растворимы в воде (кроме фосфата, карбоната и сульфида). Гидролизуются слабо ( константа диссоциации Mn(OH)2 по 2ой ступени К2=5*10-4). Многие образуют кристаллогидраты. С наиболее сильными окислителями (PbO2, KBiO3 и др.) дают марганцевую кислоту:
2 MnSO4 + 5PbO2 + 6HNO3 = 2HMnO4 + 3Pb(NO3)2 + 2PbSO4 + 2H2O
2Mn(NO3)2 + 5KBiO3 + 16HNO3 = 2HMnO4 + 5Bi(NO3)3 + 5KNO3 + 7H2O
Степень +3. Соответствующий оксид Mn2O3.
Может быть получен при нагревании MnO2: 4MnO2 = 2Mn2O3 + O2↑
Не растворяется в воде.
При взаимодействии с кислотами диспропорционирует:
Mn2O3 + 2Н+ = MnO2↓ + Mn2+ + H2O
Гидроксид Mn(OH)3 имеет основный характер. Нерастворим.
Степень +4. В кислой среде соединения с этой степенью окисления – сильные окислители. Соответствующий оксид MnO2. Амфотерный, т.к известны соединения, в которых Mn+4 существует и катионной форме ( Mn(SO)4, MnF4), и в анионной форме (CaMnO3). Соответсвующий гидроксид – марганцовистая кислота H2MnO4. Эта кислота не выделена ни в виде индивидуального вещества, ни в виде растворов. Ее соли – манганаты.
Получение:
прокаливание нитрата марганца (II): Mn(NO3)2 = MnO2 + 2NO2↑
3MnSO4 + 2KMnO4 +2H2O = 5MnO2↓ + K2SO4 + 2H2SO4 (образуется гидратированный оксид MnO2*nH2O).
Растворяется только в горячих H2SO4 (конц) и HCl (конц). Это ОВР:
2MnO2 + 2H2SO4 = 2MnSO4 + O2↑ + 2H2O
MnO2 + 4HCl = MnCl2 + Cl2↑ + 2H2O
Реакция идет через промежуточное образование темно-красного комплекса:
MnO2 + 6 HCl = H2[MnCl6] + 2 H2O
H2[MnCl6] → MnCl4 + 2 HCl → MnCl2 + Cl2
Окислительная способность оксида зависит от рН среды. Это следует из уравнения Нернста для полуреакции:
MnO2 + 4H+ + 2e = Mn2+ + 2H2O.
Электродный потенциал тем выше, чем меньше рН .
Взаимодействие с сильными окислителями:
В щелочной среде до манганатов: MnO2 + KNO3 + K2CO3 = K2MnO4 + KNO2 + CO2↑
сплавление
В кислой среде до марганцевой кислоты:
2MnO2 + 3PbO2 + 6HNO3 = 2HMnO4 + 3Pb(NO3)2 + 2H2O
Степень +7. Соответствующий оксид Mn2O7. Неустойчив. При разложении происходит взрыв: 2Mn2O7 =4 MnO2 + 3O2↑
Получить оксид можно при добавлении кристаллического перманганата калия к концентрированной серной кислоте:
2KMnO4 + 2H2SO4 (конц) = Mn2O7 + 2KHSO4 + H2O
При стандартных условиях жидкий. Проявляет кислотные свойства.
Растворяется в воде: Mn2O7 + H2O = 2HMnO4 (марганцевая кислота).
Марганцевая кислота существует только в растворах. Самая сильная в ряду HMnO4 -HTcO4 - HReO4.
Перманганат калия – широко используется в лабораторной практике и в промышленности.
Получают из манганата калия (калийная соль) – соли марганца (VI). Эта соль хорошо растворима в воде, но в нейтральной среде диспропорционирует:
3K2MnO4 + 2H2O = 2KMnO4 + MnO2↓ + 4KOH
Перманганат калия – сильный окислитель.
Перманганат как окислитель в кислой среде:
2 KMnO4 + 3 H2SO4 + 5 K2SO3 = 2 MnSO4 + 3 H2O + 6 K2SO4
2 KMnO4 + 5 SO2 + 2 H2O = 2 MnSO4 + K2SO4 + 2 H2SO4
2 KMnO4 + 16 HCl = 2 KCl + 2 MnCl2 + 5 Cl2 + 8 H2O
В нейтральной среде:
2 KMnO4 + H2O + 3 Na2SO3 = 2 MnO2 + 2 KOH + 3 Na2SO4
2 KMnO4 + 3 MnCl2 + 2 H2O = 5 MnO2 + 2 KCl + 4 HCl
В щелочной среде:
2 KMnO4 + 2 KOH + Na2SO3 = 2 K2MnO4 + H2O + K2SO4
Металлический марганец используется в сплавах. Специальная твердая износостойкая сталь для зубцов ковшей экскаваторов и т.п. содержит до 15% марганца.
Этот элемент жизненно необходим для нормального функционирования живого организма. он входит в состав многих ферментов. Например, входит в состав аргиназы, которая ускоряет гидролиз аргинина с образованием орнитина и мочевины.
Билет 61 Железо,кобальт,никель.Свойства простых веществ.Степениокисления,свойства гидроксидов в зависимости от степени окисления. Кадмиево-никелевый акккумулятор.Биологическая роль соединений желеша,кобальта, никеля.

+2- наиб.хар-ка
+3-стабильна дляFe(в меньшей степепи для Со)
+4, +6 – второстепенное значение
Свойства
Тугоплавкие, пластичные
Ферромагнитные (могут намагничиваться и в намагниченном состоянии)
В обычных условиях сравнительно низкая реакционная способность, но вообще Meср. акт-ти.
Коррозия железа.

Сoи
 при
обычных усл. Устойчивы, вмелкораздроб.
состоянии пироморфны
при
обычных усл. Устойчивы, вмелкораздроб.
состоянии пироморфны
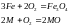
 (при
t)
(при
t)

 (при
t)
(при
t)
3.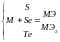
4.
 (при
t)
(при
t)
5.

Свойства гидроксидов в зависимости от CO
 -
преобладание
основных св-в
-
преобладание
основных св-в
Основность
от Fe
до Ni
Но с очень конц щелочами
 образуют
образуют проявляют слабо выраженную амфотерность
проявляют слабо выраженную амфотерность

Кадмиево–никелевый аккумулятор

При
заряжании равновесие смещается
влевот.к.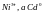 .
На положительном электроде Ni
электроны бегут от CdкNi
.
На положительном электроде Ni
электроны бегут от CdкNi
Биологическая роль Fe, Co,Ni
Fe-жизненно необходимый элемент,входит в состав гемоглобина+ ферменты дых.цепи.
Co
- микроэлементы в организме в виде
 в больших количествах токсичен.
в больших количествах токсичен.
Ni процессы кроветворения и углеводного обмена, в больших количествах токсичен.

