
- •34. Водород. Атом и молекула водорода, изотопы водорода. Гидриды металлов и неметаллов. Водород как окислитель и восстановитель. Получение водорода в лаборатории и в промышленности.
- •36. Вода. Фазовая диаграмма воды. Физические и химические свойства. Автопротолиз. Горение водорода в кислороде. Топливные элементы.
- •37. Пероксид водорода. Окислительно-восстановительные свойства, получение и применение пероксида водорода. Пероксиды металлов.
- •39. Галогеноводороды. Физические и химические свойства (температуры кипения, сила кислот и восстановительная способность). Особенности фтороводорода. Биологическая роль галогенов.
- •40.Кислородные кислоты галогенов. Кислотно-основные и окислительные свойства оксокислот хлора. Устойчивость кислородных кислот хлора и их солей, применение солей оксокислот хлора.
- •41. Сера. Строение молекул и свойства простого вещества. Сероводород и сульфиды. Полисульфиды. Восстановительные свойства сероводорода и сульфидов, растворимость сульфидов металлов.
- •42. Оксиды серы. Получение и свойства оксидов серы (IV) и (VI). Сернистая и серная кислота, сульфиты и сульфаты. Окислительно-восстановительные свойства сульфитов и сульфатов.
- •43. Общая характеристика элементов vа группы. Свойства простых веществ. Выбор стандартного состояния фосфора. Водородные соединения элементов vа группы, сравнение их электронодонорных свойств.
- •44. Азот, аммиак
- •Билет 45. Оксиды азота
- •Билет 46. Азотная и азотистая кислота, нитраты и нитриты.Окислительно-восстановительныесв-ва нитритов и нитратов. Применение нитратов.
- •47. Кислородсодержащие кислоты фосфора. Полифосфорные кислоты, атф. Растворимость солей ортофосфорной кислоты и их гидролиз.
- •48. Углерод. Полиморфные модификации. Карбиды металлов. Оксиды углерода. Угольная кислота и ее соли. Роль карбонатов в углекислотном балансе атмосферы. “Парниковый” эффект.
- •49. Кремний. Силициды металлов. Силаны. Кремниевые кислоты и силикаты. Стекло.
- •52. Бор. Бороводороды, трехцентровые связи. Боразотные аналоги углеводородов. Борная кислота, пероксобораты.
- •57. Металлы iiв группы. Свойства простых веществ. Степени окисления, свойства гидроксидов, сульфидов. Биологическая роль соединений элементов iiв группы.
- •59. Кислоты и соли, образуемые элементами viв группы в высших степенях окисления. Сравнение кислотных и окислительных свойств.
- •Билет 60. Про марганец
- •Билет №62 Чугуний.
Билеты по неорге
Оглавление
34. Водород. Атом и молекула водорода, изотопы водорода. Гидриды металлов и неметаллов. Водород как окислитель и восстановитель. Получение водорода в лаборатории и в промышленности. 2
35. Кислород. Бирадикальный характер молекулы кислорода, объяснение с помощью энергетической диаграммы. Получение кислорода в лаборатории и в промышленности. Озон, роль озонового 35. Кислород. Бирадикальный характер молекулы кислорода, объяснение с помощью энергетической диаграммы. Получение кислорода в лаборатории и в промышленности. Озон, роль озонового слоя атмосферы. 5
36. Вода. Фазовая диаграмма воды. Физические и химические свойства. Автопротолиз. Горение водорода в кислороде. Топливные элементы. 8
37. Пероксид водорода. Окислительно-восстановительные свойства, получение и применение пероксида водорода. Пероксиды металлов. 10
Билет №38.Галогены. Атомы, молекулы и простые вещества. Закономерности изменения прочности связи в молекулах галогенов. Проявляемые степени окисления. Реакции диспропорционирования молекулярных галогенов. 12
39. Галогеноводороды. Физические и химические свойства (температуры кипения, сила кислот и восстановительная способность). Особенности фтороводорода. Биологическая роль галогенов. 14
40.Кислородные кислоты галогенов. Кислотно-основные и окислительные свойства оксокислот хлора. Устойчивость кислородных кислот хлора и их солей, применение солей оксокислот хлора. 17
41. Сера. Строение молекул и свойства простого вещества. Сероводород и сульфиды. Полисульфиды. Восстановительные свойства сероводорода и сульфидов, растворимость сульфидов металлов. 20
42. Оксиды серы. Получение и свойства оксидов серы (IV) и (VI). Сернистая и серная кислота, сульфиты и сульфаты. Окислительно-восстановительные свойства сульфитов и сульфатов. 23
43. Общая характеристика элементов VА группы. Свойства простых веществ. Выбор стандартного состояния фосфора. Водородные соединения элементов VА группы, сравнение их электронодонорных свойств. 26
44. АЗОТ, АММИАК 29
Билет 45. Оксиды азота 32
Билет 46. Азотная и азотистая кислота, нитраты и нитриты.Окислительно-восстановительныесв-ва нитритов и нитратов. Применение нитратов. 36
47. Кислородсодержащие кислоты фосфора. Полифосфорные кислоты, АТФ. Растворимость солей ортофосфорной кислоты и их гидролиз. 38
48. Углерод. Полиморфные модификации. Карбиды металлов. Оксиды углерода. Угольная кислота и ее соли. Роль карбонатов в углекислотном балансе атмосферы. “Парниковый” эффект. 41
49. Кремний. Силициды металлов. Силаны. Кремниевые кислоты и силикаты. Стекло. 44
50. Металлы IА группы. Получение и применение свободных металлов и их соединений. Оксиды, пероксиды и надпероксиды щелочных металлов. Гидроксиды и гидриды. Биологическая роль соединений натрия и калия. 46
51. Металлы IIА группы. Свойства и применение простых веществ. Свойства оксидов и гидроксидов, сульфатов и карбонатов. Жестокость воды и способы ее устранения. Биологическая роль соединений элементов IIА группы. 49
52. Бор. Бороводороды, трехцентровые связи. Боразотные аналоги углеводородов. Борная кислота, пероксобораты. 53
53. Алюминий. Свойства, получение и применение алюминия и его сплавов. Оксид и гидроксид алюминия. Безводный хлорид алюминия. Гидролиз солей алюминия. Алюмотермия. Биологическая роль алюминия; производство алюминия и окружающая среда. 56
54. Олово и свинец. Простые вещества, соединения в низших и высших степенях окисления. Кислотно-основные свойства гидроксидов в зависимости от степени окисления. Свинцовый аккумулятор. Биологическая роль олова и свинца. 58
55. Общая характеристика переходных металлов. Строение атомов. Степени окисления, зависимость свойств соединений от степени окисления (на примере 2-х элементов). Комплексные соединения переходных металлов (3 примера). 61
56. Металлы IВ группы. Свойства простых веществ. Устойчивые степени окисления. Свойства соединений меди (3 примера реакций). Комплексные соединения меди, серебра, золота (по 1 примеру). Биологическая роль соединений меди. 62
57. Металлы IIВ группы. Свойства простых веществ. Степени окисления, свойства гидроксидов, сульфидов. Биологическая роль соединений элементов IIВ группы. 65
58. Элементы VIВ группы. Свойства простых веществ. Степени окисления, свойства гидроксидов в зависимости от степени окисления. Гидролиз солей хрома (III). Биологическая роль соединений элементов VIВ группы. 68
59. Кислоты и соли, образуемые элементами VIВ группы в высших степенях окисления. Сравнение кислотных и окислительных свойств. 73
Билет 60. Про марганец 76
Билет 61 Железо,кобальт,никель.Свойства простых веществ.Степениокисления,свойства гидроксидов в зависимости от степени окисления. Кадмиево-никелевый акккумулятор.Биологическая роль соединений желеша,кобальта, никеля. 81
Билет №62 Чугуний. 83
34. Водород. Атом и молекула водорода, изотопы водорода. Гидриды металлов и неметаллов. Водород как окислитель и восстановитель. Получение водорода в лаборатории и в промышленности.
Атом водорода – простейший объект химии.
Радиус атома 0,5*10-10 м, а его иона – 1,2*10-15 м.
Такая разница в размерах атома и его катиона (5 порядков) уникальна. Благодаря малому размеру протона осуществляется обменная водородная связь, прежде всего между атомами кислорода, азота и фтора.
Самый распространенный элемент в космосе (88,6% атомов, 11,3% атомов приходится на гелий, и только 0,1% – атомы всех остальных элементов) [1].
Простое вещество водород лёгкий бесцветный газ. Нетоксичен. Растворим в этаноле и ряде металлов: железе, никеле, палладии, титане, платине.
Водород плавится при 14 К, кипит при 20,3 К (давление 1 атм), плотность жидкого водорода всего 71 г/л (в 14 раз легче воды).
В разреженной межзвездной среде обнаружены возбужденные атомы водорода с переходами вплоть до n 733 732 с длиной волны 18 м, что соответствует боровскому радиусу (r = n2 *0,5*10-10 м) порядка 0,1 мм (!).
Поскольку протоны имеют спин 1/2, существуют три варианта молекул водорода:
ортоводород о-Н2 с параллельными ядерными спинами,
параводород п-Н2 с антипараллельными спинами,
нормальный н-Н2 – смесь 75% орто-водорода и 25% пара-водорода.
При превращении о-Н2 п-Н2 выделяется 1418 Дж/моль.
Значение параметров (св-ва) для форм водорода примерно одинаково.
Так как атомная масса водорода – минимально возможная, его изотопы – дейтерий D (2H) и тритий T (3H) существенно отличаются от протия 1Н по физическим и химическим свойствам. Например, замена одного из водородов в органическом соединении на дейтерий заметно отражается на его колебательном (инфракрасном) спектре, что позволяет устанавливать структуру сложных молекул.
От протия к дейтерию увеличиваются температуры кипения, плавления.
Основной метод получения водорода в промышленности – конверсия метана или гидратация угля при 800-11000С (катализатор):
CH4 + H2O = CO + 3 H2
«Водяной газ»: C + H2O = CO + H2 выше 10000С
Затем конверсия CO: CO + H2O = CO2 + H2 4000C, окислы кобальта
Суммарно: C + 2 H2O = CO2 + 2 H2
Другие источники водорода.
Коксовый газ: около 55% водорода, 25% метана, до 2% тяжелых углеводородов, 4-6% СО, 2% СО2, 10-12% азота.
Водород, как продукт горения (пиротехника!):
Si + Ca(OH)2 + 2 NaOH = Na2SiO3 + CaO + 2 H2
На 1 кг пиротехнической смеси выделяется до 370 л водорода [2].
Получение в лаборатории:
Разб. К-та + Ме
Ca + H2O
Гидролиз гидридов
Al / Zn + NaOH
Электролиз: H3O‑+ + H2
Водород как OX и RED. Атом. Он способен терять электрон, превращаясь в катион Н+, и в этом отношении похож на щелочные металлы, которые также проявляют степень окисления +1.
Н2 + О2 = Н2О
С другой стороны атом водорода может и присоединять электрон, образуя при этом анион Н –, электронная конфигурация которого — такая же, как у атома гелия. Этим водород напоминает галогены, анионы которых имеют электронные конфигурации соседних благородных газов. Таким образом, водород обладает двойственной природой, проявляя как окислительную, так и восстановительную способность.
![]() (Ох)
(Ох)
35. Кислород. Бирадикальный характер молекулы кислорода, объяснение с помощью энергетической диаграммы. Получение кислорода в лаборатории и в промышленности. Озон, роль озонового 35. Кислород. Бирадикальный характер молекулы кислорода, объяснение с помощью энергетической диаграммы. Получение кислорода в лаборатории и в промышленности. Озон, роль озонового слоя атмосферы.
Кислоро́д — элемент 16-й группы, второго периода ПС, с атомным номером 8.
Кислород — химически активный неметалл, является самым лёгким элементом из группы халькогенов.
Простое вещество кислород при нормальных условиях — газ без цвета, вкуса и запаха, молекула которого состоит из двух атомов кислорода. Жидкий кислород имеет светло-голубой цвет, а твёрдый представляет собой кристаллы светло-синего цвета.
Электронное строение атомов. 6 электронов на внешнем энергетическом уровне.
Характерные валентности – 2, степени окисления: -2, −1, -½, -⅓, 0, ½, +1, +2
Бирадикальный характер молекулы кислорода. Объяснение с помощью энергетической диаграммы.
Молекула кислорода парамагнитна (практически – бирадикал), поэтому высока ее активность. Органические вещества на воздухе окисляются через стадию образования пероксидов.
Атомы парамагнетика обладают собственными магнитными моментами, которые под действием внешних полей ориентируются по полю и тем самым создают результирующее поле, превышающее внешнее.
Парамагнетики втягиваются в магнитное поле. У кислорода это происходит за счет наличия неспаренных электронов (они взаимод. с магнитным полем).
Можно не строго, но наглядно описать бирадикальный х-р молекулы с пом. энергетич. диаграммы.
При большой разности энергий 2s- и 2p-подуровней взаимодействующих атомов можно считать, что одна пара молекулярных орбиталей сигма-типа образуется в р-те перекрывания только атомных 2s-орбиталей с малым участием 2р-орбиталей.
На двух разрыхляющих p-орбиталях имеются неспаренные электроны, которые обусловливают взаимодействие с магнитным полем, т.е. парамагнитность молекул.
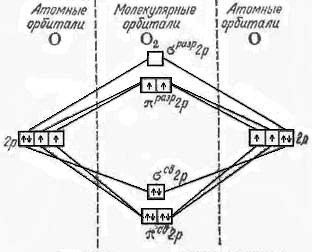
Получение кислорода в лаборатории и в промышленности.
В промышленности:
Из воздуха. Основным промышленным способом получения кислорода, является криогенная ректификация. Также хорошо известны и успешно применяются в промышленности кислородные установки, работающие на основе мембранной технологии.
Получение кислорода в лаборатории:
2 KMnO4 = K2MnO4 + MnO2 + O2 (tо)
![]()
Получение кислорода при горении пиросмеси:
NaClO3 = NaCl + 1,5 O2 + 50,5 кДж
ОЗОН
При нормальных условиях — голубой газ. При сжижении превращается в жидкость цвета индиго. В твёрдом виде представляет собой тёмно-синие, практически чёрные кристаллы.
Центральный атом кислорода sp²-гибридизован, имеет одну неподелённую пару электронов.
Порядок каждой связи 1,5, резонансные структуры — с локализованной одинарной связью с одним атомом и двойной с другим и наоборот. Молекула полярна.
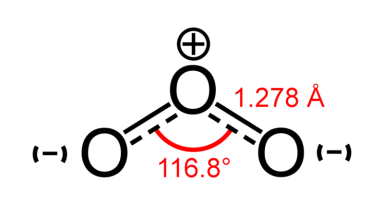
Озоновый словй в стратосфере – защита живого от жесткого УФ
