
- •Инерциальные системы отсчета. Понятия силы и инертной массы. Законы динамики. Силы в природе. Фундаментальные взаимодействия. Свойства сил упругости и тяготения. Свойства сил трения.
- •Колебания математического и физического маятников.
- •Преобразования Галилея. Механический принцип относительности. Нарушение классического закона сложения скоростей. Опыты по определению скорости света. Опыт Майкельсона.
- •Среднеквадратичная скорость молекул. Молекулярно-кинетическое толкование абсолютной температуры.
- •Основное уравнение молекулярно-кинетической теории (вывод). Число степеней свободы молекулы. Закон распределения энергии по степеням свободы. Внутренняя энергия идеального газа.
- •Изопроцессы идеального газа. Зависимость теплоемкости от вида процесса. Адиабатический процесс.
- •Тепловые двигатели и холодильные машины. Кпд. Обратимые и необратимые процесы. Круговой процесс. Цикл Карно для идеального газа и его кпд
- •Принцип работы цикла Карно.
- •Закон Максвелла для распределения молекул идеального газа по скоростям теплового движения. Вероятностное толкование закона распределения Максвелла
- •Явления переноса. Теплопроводность, диффузия, вязкость.
- •Реальные газы. Силы и потенциальная энергия межмолекулярного взаимодействия. Уравнение Ван-дер-Ваальса. Изотермы реального газа. Критическое состояние. (Внутренняя энергия реального газа.)
Явления переноса. Теплопроводность, диффузия, вязкость.
В термодинамически неравновесных системах происходят особые необратимые процессы, называемые явлениями переноса, в результате которых осуществляется пространственный перенос массы, импульса, энергии. К явлениям переноса относятся теплопроводность (перенос энергии), диффузия (перенос массы) и внутреннее трение (перенос импульса).
Теплопроводность - это процесс переноса внутренней энергии от более нагретых частей тела (или тел) к менее нагретым частям (или телам), осуществляемый хаотически движущимися частицами тела (атомами, молекулами, электронами и т. п.). Такой теплообмен может происходить в любых телах с неоднородным распределением температур, но механизм переноса теплоты будет зависеть от агрегатного состояния вещества.
Диффузия - процесс взаимного проникновения молекул одного вещества между молекулами другого, приводящий к самопроизвольному выравниванию их концентраций по всему занимаемому объёму.
Внутреннее трение (вязкость). Суть механизма возникновения внутреннего трения между параллельными слоями газа (жидкости), которые движутся с различными скоростями, есть в том, что из-за хаотического теплового движения осуществляется обмен молекулами между слоями, в результате чего импульс слоя, который движется быстрее, уменьшается, который движется медленнее - увеличивается, что приводит к торможению слоя, который движется быстрее, и ускорению слоя, который движется медленнее.
Реальные газы. Силы и потенциальная энергия межмолекулярного взаимодействия. Уравнение Ван-дер-Ваальса. Изотермы реального газа. Критическое состояние. (Внутренняя энергия реального газа.)
Реальный газ - это газ, который не описывается уравнением состояния идеального газа Клапейрона-Менделеева.
В отличие от идеального газа, молекулы реального газа не являются материальными точками (они имеют свой размер), взаимодействуют на расстоянии, а их столкновения не являются абсолютно упругими.
Уравнение
состояния реального газа (Уравнение
Ван-дер-Ваальса) имеет следующий вид:
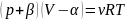 ,
где α и β - экспериментальные
константы, учитывающие отклонение
свойств реального газа от свойств
идеального газа.
,
где α и β - экспериментальные
константы, учитывающие отклонение
свойств реального газа от свойств
идеального газа.
Изотермы реального газа:
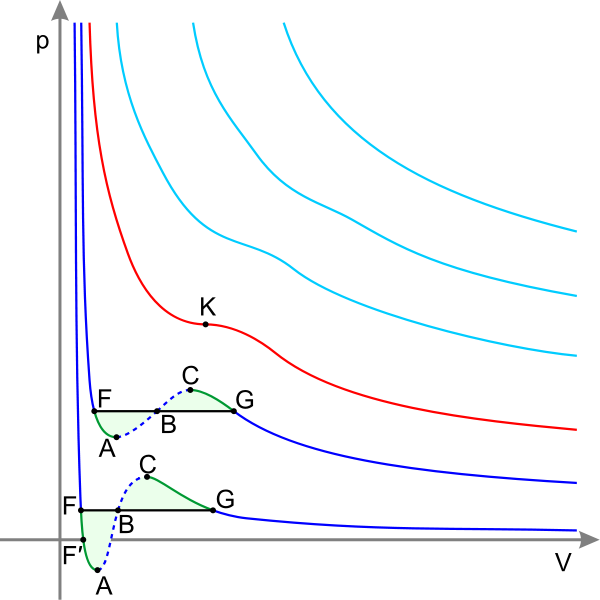
Синие - изотермы при температуре ниже критической. Зелёные участки на них - метастабильные состояния.
Участок левее точки F - нормальная жидкость.
Точка F - точка кипения.
Прямая FG - равновесие жидкой и газообразной фазы.
Участок FA - перегретая жидкость.
Участок F′A - растянутая жидкость (p<0).
Участок AC - аналитическое продолжение изотермы, физически невозможен.
Участок CG - переохлаждённый пар.
Точка G - точка росы.
Участок правее точки G - нормальный газ.
Площади фигуры FAB и GCB равны.
Красная - критическая изотерма.
K - критическая точка.
Если газ находится при температуре выше критической (индивидуальна для каждого газа), то его уже невозможно превратить в жидкость, какое бы давление к нему не прилагалось.
