
- •Инерциальные системы отсчета. Понятия силы и инертной массы. Законы динамики. Силы в природе. Фундаментальные взаимодействия. Свойства сил упругости и тяготения. Свойства сил трения.
- •Колебания математического и физического маятников.
- •Преобразования Галилея. Механический принцип относительности. Нарушение классического закона сложения скоростей. Опыты по определению скорости света. Опыт Майкельсона.
- •Среднеквадратичная скорость молекул. Молекулярно-кинетическое толкование абсолютной температуры.
- •Основное уравнение молекулярно-кинетической теории (вывод). Число степеней свободы молекулы. Закон распределения энергии по степеням свободы. Внутренняя энергия идеального газа.
- •Изопроцессы идеального газа. Зависимость теплоемкости от вида процесса. Адиабатический процесс.
- •Тепловые двигатели и холодильные машины. Кпд. Обратимые и необратимые процесы. Круговой процесс. Цикл Карно для идеального газа и его кпд
- •Принцип работы цикла Карно.
- •Закон Максвелла для распределения молекул идеального газа по скоростям теплового движения. Вероятностное толкование закона распределения Максвелла
- •Явления переноса. Теплопроводность, диффузия, вязкость.
- •Реальные газы. Силы и потенциальная энергия межмолекулярного взаимодействия. Уравнение Ван-дер-Ваальса. Изотермы реального газа. Критическое состояние. (Внутренняя энергия реального газа.)
Среднеквадратичная скорость молекул. Молекулярно-кинетическое толкование абсолютной температуры.
(Определение среднеквадратичной скорости не нашёл.)
Среднеквадратичную
скорость можно вычислить по следующей
формуле:
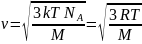 ,
где k - постоянная
Больцмана, NA
- число Авогадро, R -
универсальная газовая постоянная, T
- температура газа, M
- молярная масса газа.
,
где k - постоянная
Больцмана, NA
- число Авогадро, R -
универсальная газовая постоянная, T
- температура газа, M
- молярная масса газа.
С точки
зрения молекулярно-кинетической теории,
температура - это мера кинетической
энергии движения молекул. Абсолютная
температура прямо пропорциональна
средней кинетической энергии движения
молекул:
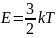 ,
где T - абсолютная
температура, выраженная в кельвинах -
абсолютная температурная шкала, отсчёт
в которой начинается с абсолютного нуля
температуры, который означает прекращение
движения молекул.
,
где T - абсолютная
температура, выраженная в кельвинах -
абсолютная температурная шкала, отсчёт
в которой начинается с абсолютного нуля
температуры, который означает прекращение
движения молекул.
Основное уравнение молекулярно-кинетической теории (вывод). Число степеней свободы молекулы. Закон распределения энергии по степеням свободы. Внутренняя энергия идеального газа.
Основное
уравнение МКТ:
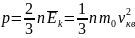 ,
где p - давление газа,
n - концентрация газа
(число молекул в 1 м3:
,
где p - давление газа,
n - концентрация газа
(число молекул в 1 м3:
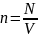 ),
),
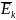 - средняя кинетическая энергия движения
молекул, m0
- масса одной молекулы, vкв
- средняя квадратичная скорость движения
молекул.
- средняя кинетическая энергия движения
молекул, m0
- масса одной молекулы, vкв
- средняя квадратичная скорость движения
молекул.
(Вывод дофига долгий, лучше загуглить википедию на экзамене.)
Число степеней свободы - это наименьшее число независимых координат, определяющих положение и конфигурацию молекулы в пространстве. Число степеней свободы для одноатомной молекулы равно 3 (поступательное движение в направлении трех координатных осей), для двухатомной - 5 (три поступательных и две вращательных, т.к. вращение вокруг оси Х возможно только при очень высоких температурах), для трехатомной - 6 (три поступательных и три вращательных).
Закон
распределения энергии по степеням
свободы связывает температуру системы
с её средней энергией в классической
статистической механике:
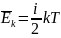 .
.
Внутренняя энергия идеального газа - это сумма кинетических энергий его частиц. Внутренняя энергия идеального газа не зависит от давления и объёма.
Работа газа при расширении. Количество теплоты. Первое начало термодинамики.
Расширяясь, газ совершает работу. При этом его внутренняя энергия превращается в механическую энергию.
Работа
газа равна:
 ,
где p - давление газа,
∆V - изменение
объёма.
,
где p - давление газа,
∆V - изменение
объёма.
Количество теплоты - это энергия, которую получает или теряет тело при теплопередаче.
Первое
начало термодинамики утверждает, что
количество теплоты, полученное системой,
идет на изменение ее внутренней энергии
и на совершение работы над внешними
телами:
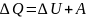 .
.
Классическая молекулярно-кинетическая теория теплоемкости. Удельная и молярная теплоемкости. Формула Майера. Границы применимости теории
Молекулярно-кинетическая теория - раздел молекулярной физики, изучающий свойства вещества на основе представлений об их молекулярном строении и определенных законах взаимодействия между атомами или молекулами, из которых состоит вещество. Считается, что частицы вещества находятся в непрерывном, беспорядочном движении, которое воспринимается как тепло.
Основное уравнение МКТ: , где p - давление газа, n - концентрация газа (число молекул в 1 м3: ), - средняя кинетическая энергия движения молекул, m0 - масса одной молекулы, vкв - средняя квадратичная скорость движения молекул.
Удельная теплоёмкость - физическая величина, численно равная количеству теплоты, которое необходимо передать телу массой 1 кг для того, чтобы его температура изменилась на 1 Кельвин.
Удельная
теплоемкость измеряется в
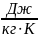 .
.
Молярная теплоёмкость - это теплоёмкость одного моля вещества.
Молярная
теплоёмкость измеряется в
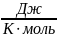 .
.
Между
удельной и молярной теплоёмкостями
существует связь:
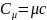 .
.
Формула
Майера (соотношение Майера):
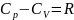 ,
где Cp
- молярная теплоёмкость при постоянном
давлении, CV
- молярная теплоёмкость при постоянном
объёме, R - универсальная
газовая постоянная.
,
где Cp
- молярная теплоёмкость при постоянном
давлении, CV
- молярная теплоёмкость при постоянном
объёме, R - универсальная
газовая постоянная.
Границы применимости МКТ: рассматриваются только системы, состоящие из большого числа частиц (N>1020); Температурный интервал, в котором молекулы и атомы можно считать бесструктурными неделимыми частицами: для молекул - 1000-3000К, для атомов – 10000К.
