
- •Занятие №4 Почвенные коллоиды
- •Свойства коллоидов:
- •Поглотительная способность почвы. Поглощение катионов.
- •Демонстрация механической поглотительной способности
- •Демонстрация коагуляции почвенных коллоидов
- •Демонстрация наличия у почвенных коллоидов заряда
- •Демонстрация наличия в почве физико-химической поглотительной способности (обменной)
Занятие №4 Почвенные коллоиды
Коллоидами называют механические элементы размером менее 0,0001 мм. В абсолютно сухой почве коллоидных свойств не возникает. При взаимодействии с водой образуется коллоидная суспензия или раствор.
По своему происхождению и составу все почвенные коллоиды можно разделить на три группы:
Минеральные коллоиды образуются в результате выветривания горных пород и минералов. Они представлены преимущественно глинистыми минералами, гидроокисями кремния (SiО2•nH2О), железа (Fe(OH)3•nH2O), алюминия (Аl(0Н)3•nH2О), марганца (Mn2O3•nH2O), а также некоторыми первичными минералами, раздробленными до коллоидного состояния (кварц).
Органические коллоиды образуются в процессе разложения и гумификации органических остатков. Они представлены в основном гумусовыми кислотами и их солями, а также белковой плазмой микроорганизмов.
Гумус – основная часть органического вещества почвы, полностью утратившая черты анатомического строения организмов.
Органо-минеральные образуются при взаимодействии гумусовых веществ с минеральными частицами
По физическому состоянию коллоиды бывают:
кристаллические
аморфные
Аморфные вещества- вещества, не имеющие кристаллической структуры
В глинистой почве содержатся больше коллоидов, чем в песчаной, т.к. в ней больше органического вещества – гумуса.
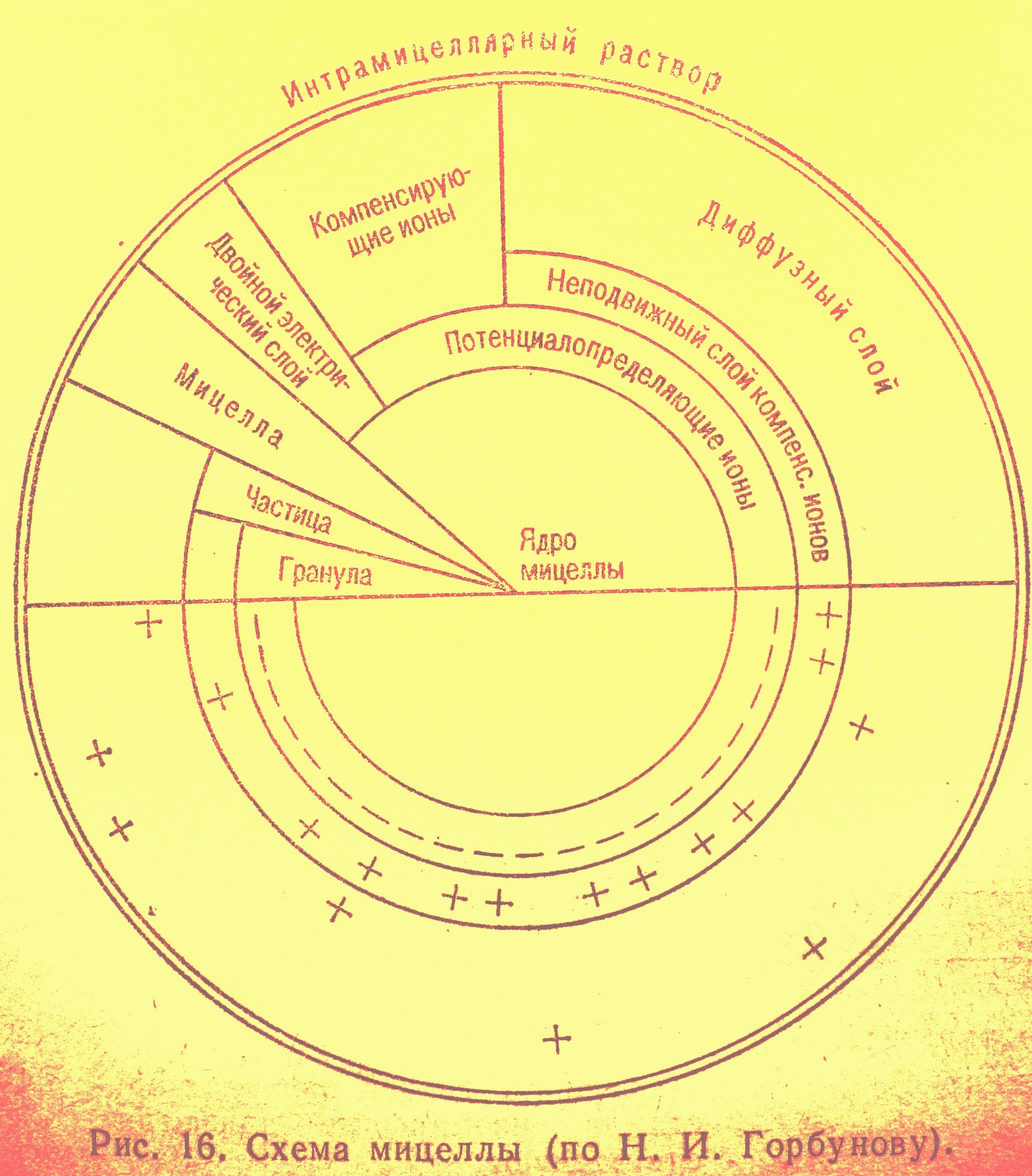
Коллоидная частица, иначе ее называют коллоидной мицеллой, имеет сложное строение.(СМ.РИС) Внутри ее находится ядро. Вокруг ядра располагается прочно связанный с ним слой ионов определенного электрического заряда, который называется слоем потенциалопределяющих ионов. К последнему примыкает слой ионов, имеющих противоположный заряд, образуется прочно связанный с частицей неподвижный слой компенсирующих ионов. В результате на поверхности ядра формируется двойной электрический слой ионов, внутреннюю обкладку которого образуют потенциалопределяющие ионы, а внешнюю — неподвижные компенсирующие ионы противоположного знака заряда.
Неподвижный слой компенсирующих ионов коллоидной частицы окружает подвижный слой компенсирующих ионов. Его называют диффузным слоем. Ионы диффузного слоя способны к различным обменным реакциям.
Коллоиды, несущие только отрицательный заряд – ацидойды (гумусовые кислоты). Несущие только положительный заряд – базойды (белки). Коллоиды, заряд которых меняется в зависимости рН – амфолитойды (гидроксилы железа и алюминия). Знак заряда коллоида определяют по потенциалопределяющему слою. Больше всего в почве отрицательно заряженных ацидойдов.(поэтому рассматриваем поглощение катионов в большей степени)
Свойства коллоидов:
Имеют заряд. (см. выше)
Образуют мицеллу (см.выше)
Мицелла (лат. mīcella букв. крошечка, частичка) - частица малых размеров, окруженная жидкой средой, в которой она не растворима.
Коагуляция
Пептизация
Коллоиды имеют одноименный электрический заряд, поэтому отталкиваясь друг от друга, образуют собой золь – коллоидный раствор, взвеси. Состояние золя – это когда все коллоиды отделены друг от друга жидкостью, и равномерно распределены в коллоидном растворе. Наблюдается при повышенной влажности.
Под действием ряда соединений, растворенных в почвенной влаге, при изменении своего состояния или смене электрического заряда они склеиваются и выпадают в осадок – гель(студенистого, хлопьевидного или аморфного коллоидного осадка). Т.о. формируется хлопьевидная масса, которая обволакивает и обуславливает коагуляцию мелких почвенных гранул в комочки. Происходит при высыхании.
Коагуляция – переход коллоида из состояния золя в состояние геля путем сцепления частиц, т.е способность коллоидов свертываться в результате слипания. При коагуляции происходит формировании структуры почвы. Коагуляция может происходить по различным причинам. В природных условиях коагуляция происходит при высушивании и замерзании почвы. Кроме того часто происходит под действием электролитов. Различают коагуляцию необратимую и обратимую.
Необратимая коагуляция происходит только под влиянием двухвалентных (Са2+, Mg2+) и трехвалентных (Al3+, Fe3+) катионов.
Электролиты — в узком смысле электролитами называют вещества, распадающиеся в растворах на ионы. Растворы электролитов также часто называют электролитами. К ним относятся растворы кислот, солей и щелочей. Электролитической диссоциации – распад вещества на ионы при растворении.
Пептизация – Обратный процесс, т. е. переход геля в золь. (см. рис). Пептизация почвенных коллоидов приводит к разрушению структуры почвы, обеднению ее гумусом и коллоидами.

Рис. Состояния почвенных коллоидов
Гидрофильность («любящие воду») (от греч. «гидро» - вода, «филео» - любить и «фобос» - боязнь) – способны удерживать воду, способны набухать, это свойство коллоидов удерживать воду. Гидрофильными являются глинистые минералы.
Гидрофобность («боящиеся воды») – слабо удерживают влагу , свойство отталкивать воду (липиды).
Коллоиды могут быть обратимыми и необратимыми. Необратимые из состояния геля не переходят в золь. Обратимые переходят из геля в золь и обратно. Необратимые формируют прочную структуру, которая не разрушается водой. Обратимые образуют не прочную структуру, например, гидрофильные коллоиды.
Примером коллоидного раствора является канцелярский силикатный клей, состоящий из воды, мелко раздробленного кварца и поваренной соли. Процесс склеивания заключается в следующем: при высыхании концентрация ионов натрия повышается – происходит коагуляция коллоидов, и гель склеивает поверхности. Однако процесс обратим, вследствие чего этого клей не водостоек.
