
- •1.Задачи современного естествознания. Проблемы естествознания на пути
- •2. Механизмы познавательной деятельности человека.
- •3. Определение модели. Место моделирования среди методов познания.
- •4. Определение модели. Классификация моделей (в зависимости от сложности объекта, от оператора модели, от целей моделирования, от параметров задачи, от методом реализации).
- •5. Этапы развития и становления естествознания. Первые научные школы,
- •6. Основные идеи классической механики. Конфигурационное пространство.
- •7. Г. Галилей. Принцип относительности и детерменированности. Движение,
- •8. Механическая картина мира. Законы Кеплера. Примеры механических
- •9. Основные законы электродинамики. Понятие поля. Основные
- •10. Максвелл, Лоренц. Классическая электродинамика.
- •11. Уравнения Максвелла и преобразования Лоренца – интерпретация и
- •12. Принцип относительности. А. Эйнштейн. Основные задачи и выводы из
- •13. Принцип относительности. Связь преобразований Лоренца и Галилея.
- •14. Основы квантовой механики. Понятия частиц и волн. Волновое
- •15. Принцип неопределенности. Гейзенберг, Планк,Шредингер.
- •16. Опыт Резерфорда. Основные задачи и выводы.
- •17.Понятия колебаний механических систем. Малые колебания. Вынужденные колебания. Затухающие колебания. Примеры и основные
- •18. Эффект синхронизации. Определения. Виды синхронизации.
- •19. Понятие “порядок-беспорядок” в природе и обществе. Синергетические
- •20. Элементы биосоциологии. Основные задачи и простейшие модели.
- •21. Введение в разностные уравнения. Примеры биологических моделей,
- •22. Задача конкуренции видов, хищник-жертва – задачи и анализ. Взгляды
- •23. Химическая кинетика. Основные понятия и математические модели.
23. Химическая кинетика. Основные понятия и математические модели.
Химическая
кинетика или кинетика химических реакций
— раздел физической химии, изучающий
закономерности протекания химических
реакций во времени, зависимости этих
закономерностей от внешних условий, а
также механизмы химических превращений.
Важным понятием химической кинетики
является скорость химической реакции.
Эта величина определяет, как изменяется
концентрация компонентов реакции с
течением времени. Скорость химической
реакции — величина всегда положительная,
поэтому если она определяется по
исходному веществу (концентрация
которого убывает в процессе р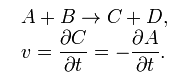 еакции),
то полученное значение домножается на
−1.
еакции),
то полученное значение домножается на
−1.
Например для реакции
скорость можно выразить так:
В 1865 году Н. Н. Бекетовым и в 1867 году К. М. Гульдбергом и П. Вааге был сформулирован закон действующих масс, согласно которому скорость химической реакции в каждый момент времени пропорциональна концентрациям реагентов, возведённым в некоторые степени. Кроме концентрации на скорость химической реакции оказывают влияние следующие факторы: природа реагирующих веществ, наличие катализатора, температура (правило Вант-Гоффа) и площадь поверхности раздела фаз.
Порядок реакции по данному веществу — показатель степени при концентрации этого вещества в кинетическом уравнении реакции. Одной из самых известных моделей математической химии является молекулярный граф. Молекулярный граф — связный неориентированный граф, находящийся во взаимно-однозначном соответствии со структурной формулой химического соединения таким образом, что вершинам графа соответствуют атомы молекулы, а рёбрам графа — химические связи между этими атомами.
