
- •В.П. Панов теоретические основы защиты окружающей среды
- •Часть 2
- •1 Адсорбционная очистка сточных вод и промышленных выбросов
- •1.1 Изотермы адсорбции в системах газообразный (жидкий) адсорбтив-твердый адсорбент
- •1.2 Теория мономолекулярной адсорбции
- •1.3 Теория полимолекулярной адсорбции
- •1.4. Теория объемного заполнения микропор
- •1.5 Избирательность адсорбции
- •1.6 Основные виды пористых адсорбентов
- •1.7 Кинетика адсорбции
- •1.8 Динамика адсорбции
1.4. Теория объемного заполнения микропор
Адсорбционные явления, протекающие на поверхности мезо-, макропор и в микропорах принципиально отличаются. Теории физической адсорбции при всем их различии рассматривают процесс как поглощение одного или нескольких последовательных слоев адсорбата на геометрической поверхности адсорбента. Микропоры представляют как области пространства в твердом теле, размеры которых соизмеримы с размерами адсорбируемых молекул. В таком случае при любой природе адсорбционных взаимодействий, обусловливающих физическую адсорбцию, во всем пространстве микропор проявляется адсорбционное поле, создаваемое твердым телом. Ограниченность адсорбционного пространства микропор предопределяет тот факт, что последовательно адсорбирующиеся в микропорах молекулы не образуют адсорбционных слоев. Адсорбция в микропорах характеризуется объемным заполнением микропор. Отсюда основным геометрическим параметром, характеризующим микропористые адсорбенты, является объем микропор, а не их поверхность.
Для микропор введено понятие величины предельной (максимальной) адсорбции А0, которая соответствует адсорбции пара при давлении, равном давлению насыщенного пара. Величина А0 зависит от температуры, и эта зависимость определяется термическим коэффициентом предельной адсорбции , который практически постоянен в широком интервале температур:
![]() .
(1.18)
.
(1.18)
Адсорбированное вещество в микропорах в поле адсорбционных сил подобно жидкости, находящейся в сильно сжатом состоянии. В области температур значительно ниже критических плотность адсорбата в первом приближении можно принять равной плотности поглощаемого вещества в жидком состоянии при температуре опыта. Более точные зависимости реальных плотностей адсорбата при разных температурах приведены в специальной литературе. Допущение о том, что плотность адсорбата соответствует плотности сжиженного пара при температуре опыта, облегчает практические расчеты, но имеет смысл только для р = рs и поэтому не всегда точно выполняется.
В практических расчетах для адсорбентов разной структуры широкое распространение получило степенное уравнение адсорбции Фрейндлиха:
![]() ,
(1.19)
,
(1.19)
где А – количество адсорбированного вещества; р – давление адсорбтива; k и n – постоянные величины.
Простота и удовлетворительное описание экспериментальных данных в широком интервале давлений, за исключением интервала очень низких давлений, когда адсорбция описывается уравнением Генри, способствовали широкому распространению уравнения Фрейндлиха.
В расчетах адсорбционных процессов часто используют линейную форму уравнения:
Рис.
1.8. Изотермы адсорбции в
координатах
уравнения
Фрейндлиха![]()
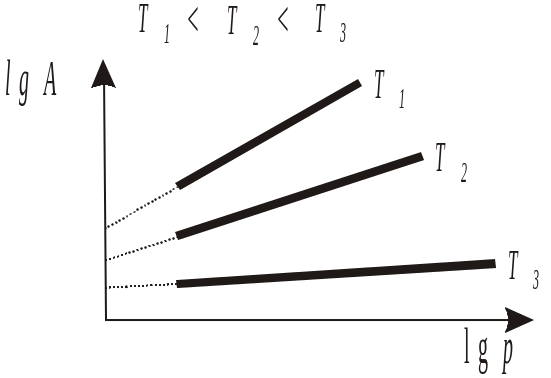
Изотермы адсорбции в координатах lg А-lg р изображаются прямой линией. Тангенс угла наклона прямых позволяет определять величину коэффициента n (рис. 1.8), а отрезки, отсекаемые ими на оси ординат, – lg k. С понижением температуры величина n последовательно увеличивается, приближаясь к предельному значению, равному 1. В предельном случае (низкая адсорбционная способность) адсорбционное равновесие аналогично процессу растворения и подчиняется закону Генри: адсорбция линейно растет с повышением давления. Значения k с ростом температуры уменьшаются.
Для пара уравнение Фрейндлиха является частным случаем более общего уравнения изотермы адсорбции теории объемного заполнения микропор:
![]() ,
(1.21)
,
(1.21)
где Е – характеристическая энергия адсорбции.
Если принять, что k = А0, а n = 0,434RT/E, то последнее уравнение совпадает с уравнением (1.20), что подтверждает сказанное выше.
