
- •В.П. Панов теоретические основы защиты окружающей среды
- •Часть 2
- •1 Адсорбционная очистка сточных вод и промышленных выбросов
- •1.1 Изотермы адсорбции в системах газообразный (жидкий) адсорбтив-твердый адсорбент
- •1.2 Теория мономолекулярной адсорбции
- •1.3 Теория полимолекулярной адсорбции
- •1.4. Теория объемного заполнения микропор
- •1.5 Избирательность адсорбции
- •1.6 Основные виды пористых адсорбентов
- •1.7 Кинетика адсорбции
- •1.8 Динамика адсорбции
1.1 Изотермы адсорбции в системах газообразный (жидкий) адсорбтив-твердый адсорбент
В качестве характеристики адсорбционных свойств твердых тел используют изотермы адсорбции, которые при всех условиях (наличие других веществ, различная кинетика процесса) являются основной характеристикой адсорбентов и определяют выбор условий проведения процессов. Совокупность изотерм адсорбции является источником информации о структуре адсорбентов, тепловом эффекте процессов и др.
Следует отметить, что твердые адсорбенты, как правило, имеют поры разного размера. В зависимости от размера поры подразделяются на три типа: микро-, мезо- и макропоры. Микропоры – наиболее мелкие поры с размерами, соизмеримыми с размерами адсорбируемых молекул, их эффективные радиусы находятся в интервале 0,5..1,5 нм. Суммарный объем микропор промышленных адсорбентов не превышает 0,5 см3/г.
Размеры мезопор лежат в интервале 1,5..200 нм. Стенки таких больших пор образованы очень большим числом атомов или молекул вещества адсорбента. Для мезопор действие адсорбционных сил характерно не во всем объеме, а практически на небольшом расстоянии от стенок. Если для микропор характеристика "удельная поверхность" не имеет физического смысла, так как адсорбция в микропорах сводится к заполнению объема микропор, то для мезопористых сорбентов важна удельная поверхность адсорбента. Удельная поверхность может изменяться для таких адсорбентов от 10 до 400 м2/г.
М
Рис. 1.1. Типы изотерм
по Брунауеру
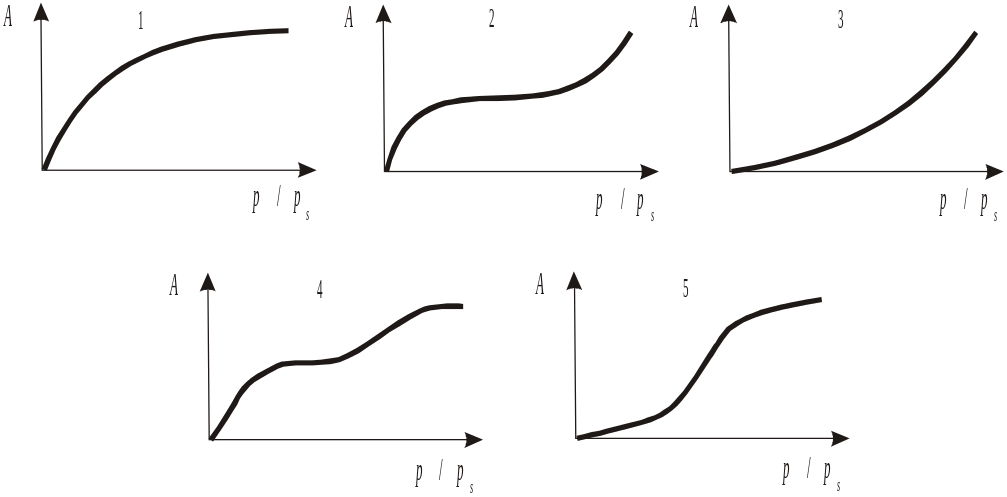
Брунауером выделены пять основных типов изотерм адсорбции в системах газ-твердое (рис. 1.1). Первый тип изотерм характерен для микропористых адсорбентов, практически не содержащих мезопор. Безусловно, это не однозначно.
Начальные выпуклые участки изотерм 2 и 4 (рис. 1.1) также связаны с наличием микропор в адсорбенте, но это преимущественно мезо- и макропористые сорбенты. Дальнейший ход кривых определяется полимолекулярной адсорбцией или капиллярной конденсацией. Начальные вогнутые участки изотерм 3 и 5, сравнительно редко встречающихся, характерны для систем адсорбат-адсорбент, когда взаимодействие молекул адсорбата и адсорбента меньше межмолекулярного взаимодействия молекул адсорбата.
Основное отличие изотерм 2 и 3 типов от изотерм 4 и 5 типов состоит в том, что объем мезопор адсорбентов (4 и 5) заполняется адсорбатом в результате капиллярной конденсации раньше, чем концентрация (или относительное давление р/рs) приблизится к 1. На изотермах 4 и 5 появляется верхний, почти горизонтальный участок.
В
Рис.
1.2. Изотермы адсорбции
для
системы адсорбент-
адсорбтив
В результате адсорбции происходит перераспределение компонентов между объемом фазы и поверхностным слоем, что влечет за собой изменение их химических потенциалов в системе. Поэтому адсорбцию иногда рассматривают как процесс превращения поверхностной энергии в химическую. Для разбавленных растворов неэлектролитов фундаментальное адсорбционное уравнение Гиббса имеет вид:
![]() ,
(1.7)
,
(1.7)
где
![]() – поверхностное натяжение или удельная
поверхностная энергия.
– поверхностное натяжение или удельная
поверхностная энергия.
В разбавленных растворах, когда концентрация адсорбтива стремится к нулю, производная в скобках будет постоянной величиной, а величина адсорбции – пропорциональна концентрации (активности) адсорбтива.
Если адсорбция происходит из газовой фазы, то, выразив концентрацию через парциальное давление, получим:
![]() .
(1.8)
.
(1.8)
Зная зависимость поверхностного натяжения раствора от концентрации (давления пара) растворенного вещества, по уравнениям (1.7) и (1.8) можно рассчитать изотерму адсорбции компонента. Единица гиббсовской адсорбции не зависит от единиц измерения концентрации (давления) в объемной фазе, а зависит от того, в каких единицах выражена газовая постоянная R. Так как R относится к молю вещества, а поверхностное натяжение – к единице площади, то и гиббсовская адсорбция всегда выражается в молях на единицу площади. Если выражается в Дж/м2, то необходимо принять R = 8,3144 Дж/(моль К), чтобы привести в соответствие все единицы измерения.
