
- •1.Ковалентная химическая связь. Особенности ковалентной связи: направленность и насыщаемость. Молекулы с нечетным числом электронов.
- •2.Понятие о скорости химической реакции. Факторы, влияющие на скорость реакции в гомогенных и гетерогенных системах.
- •3.Уравнения реакций:
- •1.Радиусы атомов,их изменение в периодах и группах Периодической системы. Зависимость кислотно-основных свойств соединения от радиуса центрального атома.
- •Сверху вниз по подгруппе:
- •2.Роль молекул растворителя в процессах электролитической диссоциации.
- •3.Уравнения реакций.
- •1.Форма и пространственное расположение s-,p-, и d- орбиталей в атоме.
- •2.Реакции самоокисления-самовосстановления (диспропорционирования).
- •3.Уравнения реакций.
- •1.Периодические и непериодические свойства атомов элементов. Полные и неполные электронные аналоги.
- •2.Основные положения теории кислот и оснований Аррениуса. Зависимость кислотно-основных свойств соединений от степени окисления центрального атома.
- •3.Уравнения реакций.
- •1.Характеристики химической связи – энергия, длина, кратность, полярность.
- •2.Химическое равновесие. Константа равновесия. Расчет равновесных концентраций веществ.
- •3.Уравнения реакций.
- •1.Энергия ионизации; сродство к электрону; электроотрицательность атомов. Относительная электроотрицательность. Изменение в периодах и группах Периодической системы.
- •2.Электролитическая диссоциация сильных и слабых электролитов в водных растворах. Вычисление концентраций ионов.
- •3.Уравнения реакций.
- •1.Планетарная модель атома водорода Резерфорда, постулаты Бора.
- •2.Стандартная энтропия веществ. Изменение энтропии при изменении агрегатного состояния веществ. Расчет изменения стандартной энтропии в химической реакции.
- •3.Уравнения реакций.
- •1.Координационная теория Вернера. Аммиакаты, кристаллогидраты, ацидокомплексы. Поведение комплексных соединений в растворе.
- •2.Влияние кислотности раствора на величину окислительно-восстановительного потенциала. Выбор среды для проведения окислительно-восстановительного процесса.
- •3.Уравнения реакций.
- •1.Химическое равновесие. Динамический характер химического равновесия. Влияние внешних факторов (температура, давление) на состояние равновесия.
- •2.Понятие о скорости химической реакции. Порядок и молекулярность химической реакции. Представление о механизмах химических реакций.
- •3.Уравнения реакций.
- •1.Гибридизация атомных орбиталей и геометрическая конфигурация молекул и ионов.
- •2.Амфотерность гидроксидов с точки зрения теории электролитической диссоциации. Реакции амфотерных гидроксидов с кислотами и основаниями.
- •3.Уравнения реакций
- •1.Комплексные соединения. Химическая связь в комплексных соединениях и строение комплексных ионов. Электролитическая диссоциация комплексов, ступенчатые и общая константы нестойкости.
- •2.Закон Гесса и следствия из него. Применение закона Гесса для расчета изменения энтальпии в химических реакциях.
- •3.Уравнения реакций.
- •1.Квантовомеханическая модель строения атома водорода. Квантовые числа электрона, форма s-,p- и d- орбиталей.
- •2.Равновесия в водных растворах солей, содержащих многозарядные катионы металлов. Вычисление pH (приведите примеры).
- •3.Уравнения реакций.
2.Электролитическая диссоциация сильных и слабых электролитов в водных растворах. Вычисление концентраций ионов.
Электролитическая диссоциация – это полный или частичный распад растворенного вещества на ионы. По признаку электрической проводимости все растворы можно разделить на две большие группы: растворы электролитов (проводят электрический ток) и растворы неэлектролитов (ток не проводят). Например, чистая вода, а также водные растворы сахара, глюкозы, спирта и ряда других веществ ток практически не проводят (в растворах отсутствуют ионы), поэтому эти вещества – неэлектролиты.
Напротив, раствор хлороводорода (соляная кислота) – это не просто электролит, а сильный электролит: более 99% молекул HCl в растворе распадаются на ионы H+ и Cl–. Поэтому обратную стрелку в уравнении диссоциации HCl изображают короткой или вообще не пишут. Такие же свойства у растворов HBr (бромоводородная кислота) и HI (иодоводородная кислота).
Однако вполне
похожее соединение – фтороводород HF –
не проявляет свойств сильного электролита
и в растворе ток проводит плохо. Здесь,
наоборот, в уравнении диссоциации нужна
более длинная обратная стрелка:
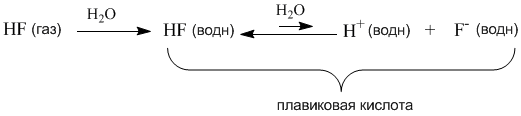
Мы видим, что наряду с процессом диссоциации на ионы, в растворах происходит и обратный процесс – ассоциация ионов в нейтральные молекулы. Таким образом, электролитическая диссоциация – это обратимая химическая реакция или динамическое равновесие, к которому применимы те же закономерности, что и к любому другому химическому равновесию. Например, для описания процесса диссоциации можно использовать константу равновесия Кр, которая в данном случае будет называться константой диссоциации Кд:
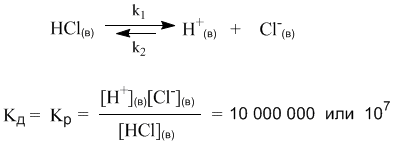
Маленький индекс (в) означает «водный» – т.е. молекулы и ионы находятся в водном растворе. Часто его не пишут, полагая, что и так все понятно.
Итак, константа диссоциации Кд – это частный случай константы равновесия. Значения Кд для сильных электролитов часто бывают настолько велики, что их не удается измерить непосредственно. Эти значения получают косвенно, из термодинамических данных, и в разных справочниках они могут отличаться, хотя и остаются очень большими. Для нас здесь важно то обстоятельство, что ионов H+ и Cl– в растворе очень много (их концентрация – в числителе дроби), а недиссоциированных молекул [HCl] чрезвычайно мало.
Напротив, Кд фтороводорода намного меньше единицы. Следовательно, в растворе много недиссоциированных молекул HF и мало ионов H+ и F–.
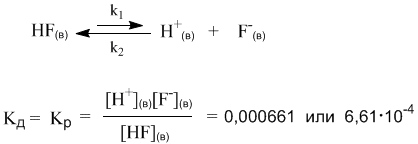
Оба раствора (HCl и HF) являются растворами электролитов, но HCl – сильный электролит, а HF – слабый. На примере этих двух веществ мы видим, что хорошую (или плохую) диссоциацию в растворе, как и хорошую (или плохую) растворимость трудно предсказать только по формуле вещества.
Водоро́дный
показа́тель— мера активности (в очень
разбавленных растворах она эквивалентна
концентрации) ионов водорода в растворе,
и количественно выражающая его
кислотность, вычисляется как отрицательный
(взятый с обратным знаком) десятичный
логарифм активности водородных ионов,
выраженной в молях на литр:
![]()
