
- •1.Ковалентная химическая связь. Особенности ковалентной связи: направленность и насыщаемость. Молекулы с нечетным числом электронов.
- •2.Понятие о скорости химической реакции. Факторы, влияющие на скорость реакции в гомогенных и гетерогенных системах.
- •3.Уравнения реакций:
- •1.Радиусы атомов,их изменение в периодах и группах Периодической системы. Зависимость кислотно-основных свойств соединения от радиуса центрального атома.
- •Сверху вниз по подгруппе:
- •2.Роль молекул растворителя в процессах электролитической диссоциации.
- •3.Уравнения реакций.
- •1.Форма и пространственное расположение s-,p-, и d- орбиталей в атоме.
- •2.Реакции самоокисления-самовосстановления (диспропорционирования).
- •3.Уравнения реакций.
- •1.Периодические и непериодические свойства атомов элементов. Полные и неполные электронные аналоги.
- •2.Основные положения теории кислот и оснований Аррениуса. Зависимость кислотно-основных свойств соединений от степени окисления центрального атома.
- •3.Уравнения реакций.
- •1.Характеристики химической связи – энергия, длина, кратность, полярность.
- •2.Химическое равновесие. Константа равновесия. Расчет равновесных концентраций веществ.
- •3.Уравнения реакций.
- •1.Энергия ионизации; сродство к электрону; электроотрицательность атомов. Относительная электроотрицательность. Изменение в периодах и группах Периодической системы.
- •2.Электролитическая диссоциация сильных и слабых электролитов в водных растворах. Вычисление концентраций ионов.
- •3.Уравнения реакций.
- •1.Планетарная модель атома водорода Резерфорда, постулаты Бора.
- •2.Стандартная энтропия веществ. Изменение энтропии при изменении агрегатного состояния веществ. Расчет изменения стандартной энтропии в химической реакции.
- •3.Уравнения реакций.
- •1.Координационная теория Вернера. Аммиакаты, кристаллогидраты, ацидокомплексы. Поведение комплексных соединений в растворе.
- •2.Влияние кислотности раствора на величину окислительно-восстановительного потенциала. Выбор среды для проведения окислительно-восстановительного процесса.
- •3.Уравнения реакций.
- •1.Химическое равновесие. Динамический характер химического равновесия. Влияние внешних факторов (температура, давление) на состояние равновесия.
- •2.Понятие о скорости химической реакции. Порядок и молекулярность химической реакции. Представление о механизмах химических реакций.
- •3.Уравнения реакций.
- •1.Гибридизация атомных орбиталей и геометрическая конфигурация молекул и ионов.
- •2.Амфотерность гидроксидов с точки зрения теории электролитической диссоциации. Реакции амфотерных гидроксидов с кислотами и основаниями.
- •3.Уравнения реакций
- •1.Комплексные соединения. Химическая связь в комплексных соединениях и строение комплексных ионов. Электролитическая диссоциация комплексов, ступенчатые и общая константы нестойкости.
- •2.Закон Гесса и следствия из него. Применение закона Гесса для расчета изменения энтальпии в химических реакциях.
- •3.Уравнения реакций.
- •1.Квантовомеханическая модель строения атома водорода. Квантовые числа электрона, форма s-,p- и d- орбиталей.
- •2.Равновесия в водных растворах солей, содержащих многозарядные катионы металлов. Вычисление pH (приведите примеры).
- •3.Уравнения реакций.
2.Реакции самоокисления-самовосстановления (диспропорционирования).
Внутримолекулярные окислительно-восстановительные процессы.
Реакции самоокисления-самовосстановления ( реакции диспро-порционирования, дисмутации) протекают с одновременным уменьшением и увеличением степени окисления атомов одного и того же элемента. Поэтому эти реакции принципиально осуществимы лишь для тех соединений, в молекулах которых есть атомы со степенью окисления, промежуточной между минимально и максимально возможной.
Реакции самоокисления-самовосстановления интересны тем, что в этом случае электроны переходят от одного атома или иоца к другому такому же атому или иону.
Реакции самоокисления-самовосстановления ( реакции диспро-порционирования, дисмутации) протекают с одновременным уменьшением и увеличением степени окисления атомов одного и того же элемента. Поэтому эти реакции принципиально осуществимы лишь для тех соединений, в молекулах которых есть атомы со степенью окисления, промежуточной между минимально и максимально возможной.
Реакция самоокисления-самовосстановления лежит в основе процессов получения гипохлоритов, хлоратов, броматов и иодатов. Реакции диспропорционирования ( реакции самоокисления-самовосстановления) - реакции, в которых происходит одновременное увеличение и уменьшение степени окисления атомов одного и того же элемента.
Гидролиз хлора является реакцией самоокисления-самовосстановления, при которой один из атомов хлора, присоединяя к себе электрон от другого атома, восстанавливается, а другой атом хлора окисляется.
Эти реакции являются примерами реакций самоокисления-самовосстановления, при которых часть атомов одного и того же элемента окисляется, а другая восстанавливается. Щелочная среда способствует протеканию реакции самоокисления-самовосстановления. Раньше реакции диспропорционирования называли реакциями самоокисления-самовосстановления, сейчас это название почти не употребляется.
Окисли́тельно-восстанови́тельные реа́кции — это встречно-параллельные химические реакции, протекающие с изменением степеней окисления атомов, входящих в состав реагирующих веществ, реализующихся путём перераспределения электронов между атомом-окислителем и атомом-восстановителем.
Внутримолекулярные — реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах одного и того же вещества, например:
2H2O → 2H2 + O2
3.Уравнения реакций.
2 K2CrO4+3 NaNO2+5 H2SO4 (разб.)-> 3 NaNO3 + Cr2(SO4)3 + 2 K2SO4 + 5 H2O
CuCO3+2 HCl-> CO2 + CuCl2 + H2O
Билет №8.
1.Периодические и непериодические свойства атомов элементов. Полные и неполные электронные аналоги.
Периодические свойства атомов.
При внимательном рассмотрении электронных формул химических элементов (это вы сделаете самостоятельно, используя материал этой лекции при самоподготовке и на специальном семинаре) можно увидеть, что структуры внешних электронных оболочек атомов периодически повторяются: при увеличении главного квантового числа n возникают одинаковые конфигурации энергетических подуровней с одинаковым числом электронов на них.
Это находит отражение в периодичности большинства свойств атомов различных элементов и свойств состоящих из них простых веществ. Эта периодичность может быть выражена более или менее ярко, в зависимости от того, насколько данное свойство зависит от электронной структуры, но прослеживается практически всегда.
Покажем это на примерах зависимости атомного радиуса, потенциала ионизации, и электроотрицательности от порядкового номера элемента:
Атомный радиус:

Потенциал ионизации:
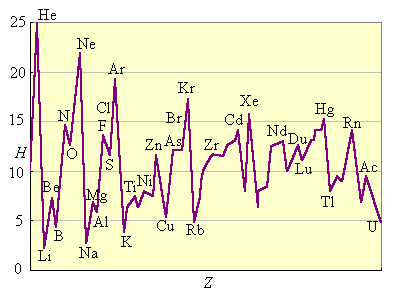
Электроотрицательность:

Непериодических свойств известно совсем немного. Это радиоактивные свойства (они зависят от свойств атомных ядер), частоты характеристических рентгеновских спектров (они зависят от заряда ядра), ядерные свойства изотопов.
Полными электронными аналогами называются элементы, которые будут иметь одинаковое строение внешнего электронного слоя во всех степенях окисления.
Неполные электронные аналоги имеют одинаковое строение внешнего слоя, только при определенной степени окисления.
Например:
N

P

Следовательно, азот и фосфор – неполные электронные аналоги.
