- •1.Ковалентная химическая связь. Особенности ковалентной связи: направленность и насыщаемость. Молекулы с нечетным числом электронов.
- •2.Понятие о скорости химической реакции. Факторы, влияющие на скорость реакции в гомогенных и гетерогенных системах.
- •3.Уравнения реакций:
- •1.Радиусы атомов,их изменение в периодах и группах Периодической системы. Зависимость кислотно-основных свойств соединения от радиуса центрального атома.
- •Сверху вниз по подгруппе:
- •2.Роль молекул растворителя в процессах электролитической диссоциации.
- •3.Уравнения реакций.
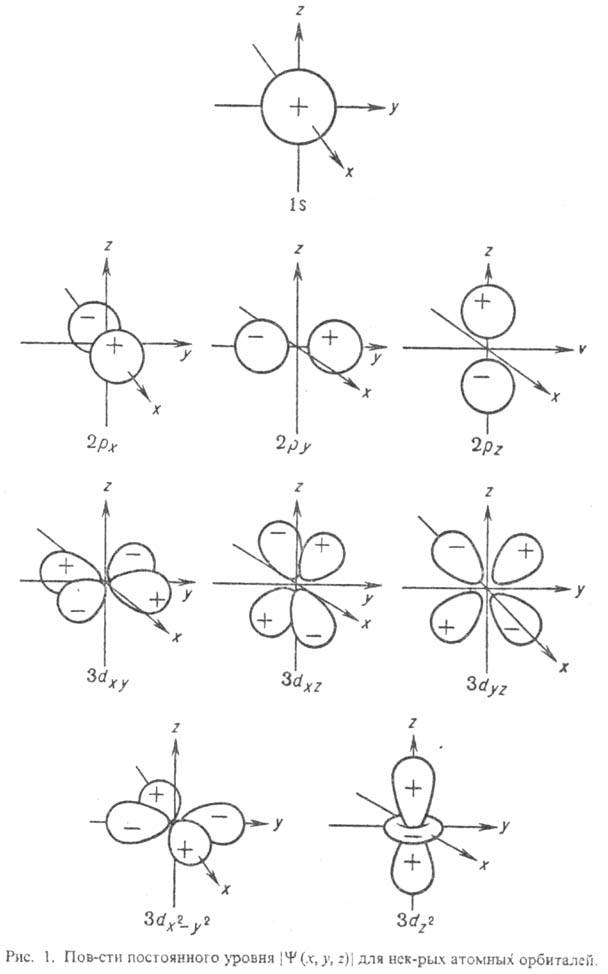
- •1.Форма и пространственное расположение s-,p-, и d- орбиталей в атоме.
- •2.Реакции самоокисления-самовосстановления (диспропорционирования).
- •3.Уравнения реакций.
- •1.Периодические и непериодические свойства атомов элементов. Полные и неполные электронные аналоги.
- •2.Основные положения теории кислот и оснований Аррениуса. Зависимость кислотно-основных свойств соединений от степени окисления центрального атома.
- •3.Уравнения реакций.
- •1.Характеристики химической связи – энергия, длина, кратность, полярность.
- •2.Химическое равновесие. Константа равновесия. Расчет равновесных концентраций веществ.
- •3.Уравнения реакций.
- •1.Энергия ионизации; сродство к электрону; электроотрицательность атомов. Относительная электроотрицательность. Изменение в периодах и группах Периодической системы.
- •2.Электролитическая диссоциация сильных и слабых электролитов в водных растворах. Вычисление концентраций ионов.
- •3.Уравнения реакций.
- •1.Планетарная модель атома водорода Резерфорда, постулаты Бора.
- •2.Стандартная энтропия веществ. Изменение энтропии при изменении агрегатного состояния веществ. Расчет изменения стандартной энтропии в химической реакции.
- •3.Уравнения реакций.
- •1.Координационная теория Вернера. Аммиакаты, кристаллогидраты, ацидокомплексы. Поведение комплексных соединений в растворе.
- •2.Влияние кислотности раствора на величину окислительно-восстановительного потенциала. Выбор среды для проведения окислительно-восстановительного процесса.
- •3.Уравнения реакций.
- •1.Химическое равновесие. Динамический характер химического равновесия. Влияние внешних факторов (температура, давление) на состояние равновесия.
- •2.Понятие о скорости химической реакции. Порядок и молекулярность химической реакции. Представление о механизмах химических реакций.
- •3.Уравнения реакций.
- •1.Гибридизация атомных орбиталей и геометрическая конфигурация молекул и ионов.
- •2.Амфотерность гидроксидов с точки зрения теории электролитической диссоциации. Реакции амфотерных гидроксидов с кислотами и основаниями.
- •3.Уравнения реакций
- •1.Комплексные соединения. Химическая связь в комплексных соединениях и строение комплексных ионов. Электролитическая диссоциация комплексов, ступенчатые и общая константы нестойкости.
- •2.Закон Гесса и следствия из него. Применение закона Гесса для расчета изменения энтальпии в химических реакциях.
- •3.Уравнения реакций.
- •1.Квантовомеханическая модель строения атома водорода. Квантовые числа электрона, форма s-,p- и d- орбиталей.
- •2.Равновесия в водных растворах солей, содержащих многозарядные катионы металлов. Вычисление pH (приведите примеры).
- •3.Уравнения реакций.
2.Роль молекул растворителя в процессах электролитической диссоциации.
Аквакомплексы металлов, их кислотные свойства.
Электролитическая диссоциация — процесс распада электролита на ионы при его растворении или плавлении. Диссоциация на ионы в растворах происходит вследствие взаимодействия растворённого вещества с растворителем; по данным спектроскопических методов, это взаимодействие носит в значительной мере химический характер. Наряду с сольватирующей способностью молекул растворителя определённую роль в электролитической диссоциации играет также макроскопическое свойство растворителя — его диэлектрическая проницаемость.
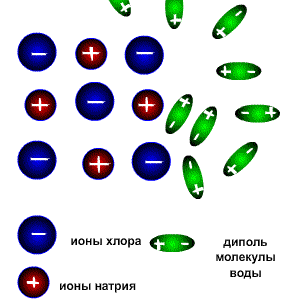
АКВАКОМПЛЕКСЫ, координац. соед., содержащие в кач-ве лигандов одну или неск. молекул воды. Последняя связана с центр, атомом металла через атом кислородаквакомплексы Различают аквакомплексы катионного типа (напр., [Со(Н2О)6]С12), анионного (напр., К[Сг(Н2О)2(ОН)4]) и комплексы-неэлектролиты (напр., [PtCl4(H20)2]).
Аквакомплексы во мн. случаях легко образуются в водных растворах из др. координац. соед. в результате внутрисферного замещения, гидратации катионов. а также присоединения молекул Н2О. В последнем случае координац. число центр. атома может повыситься, например в результате присоединения к анионам [АиС14]- или [PtCl4]- двух молекул воды.
Аквакомплексы
обладают кислотными свойствами, например:
[А1(Н20)6]3+
![]() [А1(Н20)5ОН]2+ + Н +
[А1(Н20)5ОН]2+ + Н +
Кислотные свойства аквакомплексов выражены тем сильнее, чем выше степень окисления атома-комплексообразователя.
Например, значения констант кислотности для производных железа(II) и железа(III) составляют 1,8 . 10- 7 и 6,8 . 10-3. Следовательно, равновесие протолиза в случае аквакомплекса железа(III) в большей степени смещено вправо, чем для железа(II).
3.Уравнения реакций.
MnO2+4HI->MnI2+2H2O+I2
H2SO3+Ca(OH)2->CaCO3+2H2O
Билет №6
1.Форма и пространственное расположение s-,p-, и d- орбиталей в атоме.
ОРБИТАЛЬ
(от лат. orbita-путь, колея), волновая ф-ция,
описывающая состояние одного электрона
в атоме, молекуле или др. квантовой
системе. В общем случае квантовохим.
термин "орбиталь" используется
для любой ф-ции
![]() ,
зависящей от переменных х, у, z одного
электрона. В рамках молекулярных
орбиталей методов для электронных
состояний молекул часто используют
приближенное описание квантовой системы
как целого, задавая состояние электрона
в усредненном поле, созданном ядрами и
остальными электронами системы. При
этом орбиталь
определяется одноэлектронным ур-ни-ем
Шрёдингера с эффективным одноэлектронным
гамильтонианом
,
зависящей от переменных х, у, z одного
электрона. В рамках молекулярных
орбиталей методов для электронных
состояний молекул часто используют
приближенное описание квантовой системы
как целого, задавая состояние электрона
в усредненном поле, созданном ядрами и
остальными электронами системы. При
этом орбиталь
определяется одноэлектронным ур-ни-ем
Шрёдингера с эффективным одноэлектронным
гамильтонианом
![]() ; орбитальная энергия , как правило,
соотносится с потенциалом ионизации
(см. Купманса теорема). В зависимости от
системы, для к-рой определена орбиталь,
различают атомные, молекулярные и
кристаллические орбитали.
; орбитальная энергия , как правило,
соотносится с потенциалом ионизации
(см. Купманса теорема). В зависимости от
системы, для к-рой определена орбиталь,
различают атомные, молекулярные и
кристаллические орбитали.
Все элементы
периодической системы в зависимости
от их электронного строения, можно
разделить на следующие семейства:
s-элементы
(это элементы I
и II
группы главной подгруппы,
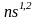 ,
где n
– число периодов), p-элементы
(это элементы с III
по VIII
группу, число валентных электронов
равно номеру подгруппы, располагаются
на p
и s
уровнях
,
где n
– число периодов), p-элементы
(это элементы с III
по VIII
группу, число валентных электронов
равно номеру подгруппы, располагаются
на p
и s
уровнях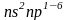 ),
например у сурьмы Sb
),
например у сурьмы Sb
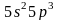 ,
d-элементы
(элементы побочных подгрупп, особенностью
их электронного строения является
заполнение предвнешего энергетического
уровня d-подуровня,
,
d-элементы
(элементы побочных подгрупп, особенностью
их электронного строения является
заполнение предвнешего энергетического
уровня d-подуровня,
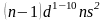 ),
f-элементы
(Ac,
La,
заполняют 3 снаружи f-подуровень,
),
f-элементы
(Ac,
La,
заполняют 3 снаружи f-подуровень,
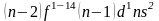 ).
).
Емкость –
максимальное число энергетического
уровня, определяющееся по формуле
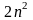 ,
где n
– номер уровня. Емкость подуровня
,
где n
– номер уровня. Емкость подуровня
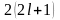 ,
где l
– орбитальное квантовое число
характеризующееся для данного подуровня.
,
где l
– орбитальное квантовое число
характеризующееся для данного подуровня.