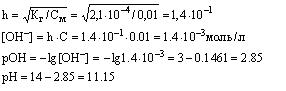- •1.Ковалентная химическая связь. Особенности ковалентной связи: направленность и насыщаемость. Молекулы с нечетным числом электронов.
- •2.Понятие о скорости химической реакции. Факторы, влияющие на скорость реакции в гомогенных и гетерогенных системах.
- •3.Уравнения реакций:
- •1.Радиусы атомов,их изменение в периодах и группах Периодической системы. Зависимость кислотно-основных свойств соединения от радиуса центрального атома.
- •Сверху вниз по подгруппе:
- •2.Роль молекул растворителя в процессах электролитической диссоциации.
- •3.Уравнения реакций.
- •1.Форма и пространственное расположение s-,p-, и d- орбиталей в атоме.
- •2.Реакции самоокисления-самовосстановления (диспропорционирования).
- •3.Уравнения реакций.
- •1.Периодические и непериодические свойства атомов элементов. Полные и неполные электронные аналоги.
- •2.Основные положения теории кислот и оснований Аррениуса. Зависимость кислотно-основных свойств соединений от степени окисления центрального атома.
- •3.Уравнения реакций.
- •1.Характеристики химической связи – энергия, длина, кратность, полярность.
- •2.Химическое равновесие. Константа равновесия. Расчет равновесных концентраций веществ.
- •3.Уравнения реакций.
- •1.Энергия ионизации; сродство к электрону; электроотрицательность атомов. Относительная электроотрицательность. Изменение в периодах и группах Периодической системы.
- •2.Электролитическая диссоциация сильных и слабых электролитов в водных растворах. Вычисление концентраций ионов.
- •3.Уравнения реакций.
- •1.Планетарная модель атома водорода Резерфорда, постулаты Бора.
- •2.Стандартная энтропия веществ. Изменение энтропии при изменении агрегатного состояния веществ. Расчет изменения стандартной энтропии в химической реакции.
- •3.Уравнения реакций.
- •1.Координационная теория Вернера. Аммиакаты, кристаллогидраты, ацидокомплексы. Поведение комплексных соединений в растворе.
- •2.Влияние кислотности раствора на величину окислительно-восстановительного потенциала. Выбор среды для проведения окислительно-восстановительного процесса.
- •3.Уравнения реакций.
- •1.Химическое равновесие. Динамический характер химического равновесия. Влияние внешних факторов (температура, давление) на состояние равновесия.
- •2.Понятие о скорости химической реакции. Порядок и молекулярность химической реакции. Представление о механизмах химических реакций.
- •3.Уравнения реакций.
- •1.Гибридизация атомных орбиталей и геометрическая конфигурация молекул и ионов.
- •2.Амфотерность гидроксидов с точки зрения теории электролитической диссоциации. Реакции амфотерных гидроксидов с кислотами и основаниями.
- •3.Уравнения реакций
- •1.Комплексные соединения. Химическая связь в комплексных соединениях и строение комплексных ионов. Электролитическая диссоциация комплексов, ступенчатые и общая константы нестойкости.
- •2.Закон Гесса и следствия из него. Применение закона Гесса для расчета изменения энтальпии в химических реакциях.
- •3.Уравнения реакций.
- •1.Квантовомеханическая модель строения атома водорода. Квантовые числа электрона, форма s-,p- и d- орбиталей.
- •2.Равновесия в водных растворах солей, содержащих многозарядные катионы металлов. Вычисление pH (приведите примеры).
- •3.Уравнения реакций.
2.Равновесия в водных растворах солей, содержащих многозарядные катионы металлов. Вычисление pH (приведите примеры).
Аквакомплексы представляют собой ионы или молекулы, в которых лигандами служат молекулы воды. В водных растворах солей почти все ионы существуют в виде акваионов, например, [Be(H2O)4]2+, [Al(H2O)6]3+, [Cr(H2O)6]3+ и т.д. При кристаллизации таких солей из водных растворов вода остается связанной с комплексообразователем:
[Be(H2O)4]SO4, [K(H2O)6][Al(H2O)6](SO4)2, [Cr(H2O)6]Cl3.
К аквакомплексам относятся многие кристаллогидраты, например, [Al(H2O)6]Cl3 (иначе – AlCl3 . 6 H2O), [Cr(H2O)6](NO3)3 (иначе – Cr(NO3)3 . 6 H2O).
У некоторых кристаллогидратов часть молекул воды входит во внутреннюю, а остальные находятся во внешней сфере и связываются с внешнесферными ионами.
Например, пентагидрат сульфата меди(II) и гептагидрат сульфата никеля(II) содержат аквакомплексы – катион тетрааквамеди(II) и катион гексаакваникеля(II) и слабо связанную внешнесферную молекулу воды, которая объединяет катионы и анионы посредством водородных связей:
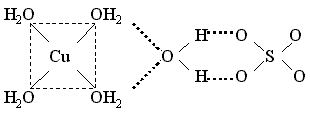
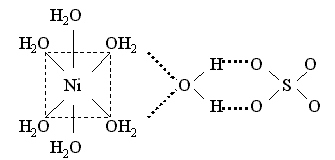
Координационные формулы указанных соединений, учитывающие состав внутренней и внешней сферы, таковы:
[Cu(H2O)4]SO4 . H2O и
[Ni(H2O)6]SO4 . H2O.
Все аквакатионы, за исключением тех, которые образованы щелочными и щелочноземельными элементами, а также таллием(I), серебром(I) и т.п., являются катионными кислотами, в водном растворе подвергаются протолизу и создают кислотную среду (рН < 7):
[Zn(H2O)4]2+ + H2O = [Zn(H2O)3(OH)]+ + H3O+
Кислотные свойства аквакомплексов выражены тем сильнее, чем выше степень окисления атома-комплексообразователя.
Например, значения констант кислотности для производных железа(II) и железа(III) составляют 1,8 . 10- 7 и 6,8 . 10-3. Следовательно, равновесие протолиза в случае аквакомплекса железа(III) в большей степени смещено вправо, чем для железа(II).
В качестве примера возьмем гидролиз ацетата натрия:
CH3COONa+HOH<—>CH3COOH+NaOH
Ионное уравнение:
CH3COO-+HOH<—>CH3COOH+OH-
Константа равновесия этой реакции
K=[CH3COOH]•[OH-]/[CH3COO- ]•[HOH]
так как концентрация воды практически остается постоянной, ее можно объединить с константой равновесия:
Kг=K•[H2O]=[CH3COOH]•[OH-]/[CH3COO-]
где Кг - константа гидролиза.
Выразим [OH-] через ионное произведение воды [OH-] =Kв / [H+] и
подставив эту величину в уравнение Кг получаем
Kг=K•Kв =[CH3COOH]•[OH-]/[CH3COO-]•[H+] =Kв/Kk
где Kk - константа диссоциации слабой кислоты.
В общем случае, если исходную концентрацию аниона слабой кислоты А- -обозначить через С моль/л, то Ch моль/л – это концентрация той части аниона А-, которая подверглась гидролизу и образовала Ch моль/л слабой кислоты HA и Ch моль/л гидроксильных ионов:A- + HOH <—> HA + OH-
C-Ch Ch Ch
где: h – степень гидролиза, т.е доля молекул соли, подвергающихся гидролизу.
Константа гидролиза соли:
![]()
При малом значении h: Kг=Сh2 откуда
![]() .
.
Так как [HA]=[OH-]=C , то Kг=[OH- ]2 /C; [H+]=Kв/[OH- ]=Kв/Kк , pH=-lg[H+].
Аналогично соотношение можно получить и при рассмотрении гидролиза соли слабого основания и сильной кислоты:
Kг=[OH- ]2 /C; [H+]=Kв/[OH- ]=Kв/Kосн
Пример: Определить pH 0.02Н раствора соды Na2C03, учитывая только первую ступень гидролиза.
Решение: Гидролиз соли протекает по уравнению
Na2CO3+HOH=NaOH+NaHCO3 или CO32-+HOH=OH-+HCO3 -
Kг=Kв/Kк=10-14/4,7•10-11=2,1•10-4
Для вычисления степени гидролиза необходимо вычислить молярную концентрацию раствора
С (Na2CO3)=0,01 моль/л