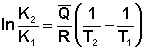- •1.Ковалентная химическая связь. Особенности ковалентной связи: направленность и насыщаемость. Молекулы с нечетным числом электронов.
- •2.Понятие о скорости химической реакции. Факторы, влияющие на скорость реакции в гомогенных и гетерогенных системах.
- •3.Уравнения реакций:
- •1.Радиусы атомов,их изменение в периодах и группах Периодической системы. Зависимость кислотно-основных свойств соединения от радиуса центрального атома.
- •Сверху вниз по подгруппе:
- •2.Роль молекул растворителя в процессах электролитической диссоциации.
- •3.Уравнения реакций.
- •1.Форма и пространственное расположение s-,p-, и d- орбиталей в атоме.
- •2.Реакции самоокисления-самовосстановления (диспропорционирования).
- •3.Уравнения реакций.
- •1.Периодические и непериодические свойства атомов элементов. Полные и неполные электронные аналоги.
- •2.Основные положения теории кислот и оснований Аррениуса. Зависимость кислотно-основных свойств соединений от степени окисления центрального атома.
- •3.Уравнения реакций.
- •1.Характеристики химической связи – энергия, длина, кратность, полярность.
- •2.Химическое равновесие. Константа равновесия. Расчет равновесных концентраций веществ.
- •3.Уравнения реакций.
- •1.Энергия ионизации; сродство к электрону; электроотрицательность атомов. Относительная электроотрицательность. Изменение в периодах и группах Периодической системы.
- •2.Электролитическая диссоциация сильных и слабых электролитов в водных растворах. Вычисление концентраций ионов.
- •3.Уравнения реакций.
- •1.Планетарная модель атома водорода Резерфорда, постулаты Бора.
- •2.Стандартная энтропия веществ. Изменение энтропии при изменении агрегатного состояния веществ. Расчет изменения стандартной энтропии в химической реакции.
- •3.Уравнения реакций.
- •1.Координационная теория Вернера. Аммиакаты, кристаллогидраты, ацидокомплексы. Поведение комплексных соединений в растворе.
- •2.Влияние кислотности раствора на величину окислительно-восстановительного потенциала. Выбор среды для проведения окислительно-восстановительного процесса.
- •3.Уравнения реакций.
- •1.Химическое равновесие. Динамический характер химического равновесия. Влияние внешних факторов (температура, давление) на состояние равновесия.
- •2.Понятие о скорости химической реакции. Порядок и молекулярность химической реакции. Представление о механизмах химических реакций.
- •3.Уравнения реакций.
- •1.Гибридизация атомных орбиталей и геометрическая конфигурация молекул и ионов.
- •2.Амфотерность гидроксидов с точки зрения теории электролитической диссоциации. Реакции амфотерных гидроксидов с кислотами и основаниями.
- •3.Уравнения реакций
- •1.Комплексные соединения. Химическая связь в комплексных соединениях и строение комплексных ионов. Электролитическая диссоциация комплексов, ступенчатые и общая константы нестойкости.
- •2.Закон Гесса и следствия из него. Применение закона Гесса для расчета изменения энтальпии в химических реакциях.
- •3.Уравнения реакций.
- •1.Квантовомеханическая модель строения атома водорода. Квантовые числа электрона, форма s-,p- и d- орбиталей.
- •2.Равновесия в водных растворах солей, содержащих многозарядные катионы металлов. Вычисление pH (приведите примеры).
- •3.Уравнения реакций.
2.Влияние кислотности раствора на величину окислительно-восстановительного потенциала. Выбор среды для проведения окислительно-восстановительного процесса.
ПОТЕНЦИАЛ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЙ (Eh) — мера интенсивности присоединения или отдачи электронов в окислительно-восстановительной реакции, представленной электродвижущей силой, выражаемой в милливольтах (мв). этот потенциал служит мерой окислительной или восстановительной способности среды; он измеряется при помощи специальных приборов и обозн. через Eh. Величина Eh зависит от изменения в растворе концентраций Н+ и ОН- ионов (т. е. от степени кислотности или щелочности среды), от соотношения концентрации окисляющего и восстанавливающегося ионов и от температуры. В частности, при добавлении в раствор кислоты или щелочи его интенсивность окисления или восстановления значительно меняется, т. е. Eh зависит от рН. Следовательно, при определении Eh нужно одновременно определить и рН. Величины применяются в геологии, литологии, гидрогеологии, гл. обр. для выяснения условий осадконакопления, характеристики вод, особенно вод нефтяных м-ний и для др. целей. Попытки определения Eh в твердых г. п., даже с естественной влажностью, еще не дали удовлетворительных результатов. Eh, при котором концентрация окислителя равна концентрации восстановителя (напр., Fe2+ = Fe3+), называется стандартным я обозн. как Еu. В качестве показателя окислительно-восстановительной системы нередко применяют значение rН (редокс ) или rН2. Значение rН — это расчетная величина окислительно-восстановительного (ОВ) потенциала, учитывающая влияние рН на ОВ систему. Для перехода от одного значения к другому существует уравнение: rН =, где 0,03 — постоянная величина для системы при t = 30 ○С. С повышением rН парциальное давление водорода в системе уменьшается, а ее окисленность увеличивается.
величение кислотности приводит к увеличению электродного потенциала, следовательно, к увеличению окислительных свойств электрохимической системы. Напротив,
уменьшение кислотности увеличивает восстановительные свойства электрохимических систем. Сказанное в первую очередь относится к системам,
в которых окисленная и восстановленная форма содержат различное коли-
чество кислорода. В тех случаях, когда содержание кислорода в окислен-
ной и восстановленной формах не меняется, влияние среды не столь вели-
ко. Это относится, например, к процессам:
Cl2 + 2e = 2Cl–; Br2 + 2e = 2Br–; I2 + 2e = 2I–.
Выбор среды (кислой или щелочной) можно сделать путем сравнения стандартной ЭДС реакций в кислой и щелочной средах. Оптимальной является та, в которой достигается большее значение ЭДС.
3.Уравнения реакций.
3Cl2+S+ 4H2O=H2SO4+6HCl
3Ba(OH)2 + 2H3PO4 (разб.) = Ba3(PO4)2+ 6H2O
Билет №18
1.Химическое равновесие. Динамический характер химического равновесия. Влияние внешних факторов (температура, давление) на состояние равновесия.
Химическое равновесие - состояние системы, в котором скорость прямой реакции (V1) равна скорости обратной реакции (V2). При химическом равновесии концентрации веществ остаются неизменными. Химическое равновесие имеет динамический характер: прямая и обратная реакции при равновесии не прекращаются.
Состояние химического равновесия количественно характеризуется константой равновесия, представляющей собой отношение констант прямой (K1) и обратной (K2) реакций.
Для реакции mA + nB « pC + dD константа равновесия равна
K = K1 / K2 = ([C]p
[D]d) / ([A]m [B]n)
Константа равновесия зависит от температуры и природы реагирующих веществ. Чем больше константа равновесия, тем больше равновесие сдвинуто в сторону образования продуктов прямой реакции.
Влияние внешних условий на химическое равновесие
При постоянстве внешних условий система может находиться в состоянии равновесия сколь угодно долго. Если изменить эти условия (т.е. оказать на систему какое-либо внешнее воздействие), равновесие нарушается; в системе возникает самопроизвольный процесс, который продолжается до тех пор, пока система опять не достигнет состояния равновесия (уже при новых условиях). Рассмотрим, как влияют на положение равновесия некоторые факторы.
Влияние давления и концентрации
Рассмотрим несколько возможных случаев смещения равновесия.
В систему добавлено исходное вещество. В этом случае
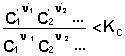
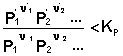
По уравнению изотермы химической реакции получаем: ΔF < 0; ΔG < 0. В системе возникнет самопроизвольный химический процесс, направленный в сторону расходования исходных веществ и образования продуктов реакции (химическое равновесие смещается вправо).
В систему добавлен продукт реакции. В этом случае
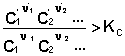
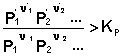
Согласно уравнению изотермы химической реакции, ΔF > 0; ΔG > 0 Химическое равновесие будет смещено влево (в сторону расходования продуктов реакции и образования исходных веществ).
3. Изменено общее давление (для реакций в газовой фазе).
Парциальные давления всех компонентов Рi в этом случае изменяются в одинаковой степени; направление смещения равновесия будет определяться суммой стехиометрических коэффициентов Δν. Учитывая, что Pi = PХi, изотерму реакции можно переписать в следующем виде (здесь Δν = Σ(νi)прод – Σ(νi)исх):
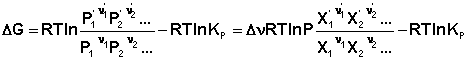
![]()
Мольные доли компонентов при изменении общего давления не изменяются. Примем, что Р2 > Р1. В этом случае, если Δν > 0 (реакция идет с увеличением числа молей газообразных веществ), то ΔG > 0; равновесие смещается влево. Если реакция идет с уменьшением числа молей газообразных веществ Δν < 0), то при увеличении общего давления ΔG < 0; равновесие смещается вправо. Иначе говоря, увеличение общего давления смещает равновесие в сторону процесса, идущего с уменьшением числа молей газообразных веществ. Уменьшение общего давления газов в смеси (Р2 < Р1) будет смещать равновесие в сторону реакции, идущей с увеличением числа молей газообразных веществ.
Необходимо отметить, что изменение концентрации или давления, смещая равновесие, не изменяет величину константы равновесия Кc и Кp, которые зависят только от природы реагирующих веществ и температуры.
Влияние температуры на положение равновесия
Повышение либо понижение температуры означает приобретение либо потерю системой энергии и, следовательно, должно изменять величину константы равновесия. Для выявления зависимости константы равновесия от температуры продифференцируем уравнение изотермы химической реакции по температуре:
![]()
![]()
Схематические графики зависимостей константы равновесия от температуры для реакций с различным тепловым эффектом приведены на рисунке 1.
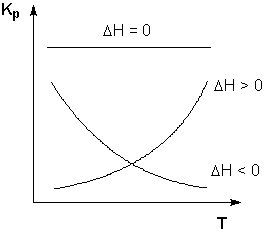
Чтобы рассчитать изменение константы равновесия при изменении температуры, уравнение изобары (изохоры) Вант-Гоффа необходимо проинтегрировать. Если принять, что тепловой эффект реакции не зависит от температуры, что обычно справедливо в достаточно узком интервале температур, то после определённого интегрирования получаем: