
- •Закон разбавления Оствальда
- •Теория отталкивания электронных пар
- •Комплексные соединения
- •Структура Периодической системы элементов
- •Классы неорганических соединений
- •Номенклатура неорганических соединений
- •Квантовые характеристики состояний электрона в атоме(квантовые числа)
- •Электронные конфигурации атомов элементов
Комплексные соединения
Комплексные соединения содержат катионный, анионный или нейтральный комплекс, состоящий из центр. атома (или иона) и связанных с ним молекул или ионов - лигандов. Центр. атом (комплексообразователь) - обычно акцептор, а лиганды - доноры электронов, и при образовании комплекса между ними возникает донорно-акцепторная, или координационная, связь.
Внутренняя сфера комплексного соединения — центральный атом со связанными с ним лигандами, то есть, собственно, комплексная частица.
Внешняя сфера комплексного соединения — остальные частицы, связанные с комплексной частицей ионной или межмолекулярными связями, включая водородные.
Центральный атом с окружающими его лигандами образуют внутреннюю сферу комплекса. Ее обычно заключают в квадратные скобки. Все остальное в комплексном соединении составляет внешнюю сферу и пишется за квадратными скобками.
ЛИГАНДЫ (от лат. ligo - связываю), нейтральные молекулы, ионы или радикалы, связанные с центр. атомом комплексного соединения. Ими м. б. ионы (Н-, Наl-, NO3-, NCS- и др.), неорг. молекулы (Н2, Сn, N2, Рn, О2, Sn, СО, СО2, NH3, NO, SO2, NO2, COS и др.), орг. соед., содержащие элементы главных подгрупп V, VI, VII гр. периодич. системы или p-донорную ф-цию.
Важнейшая количеств. характеристика донорно-акцепторной способности лигандов - дентатность, определяемая числом донорных центров лигандов, участвующих в координации.
Координационное число (КЧ) — число связей, образуемых центральным атомом с лигандами. Для комплексных соединений с монодентантными лигандами КЧ равно числу лигандов, а в случае полидентантных лигандов — числу таких лигандов, умноженному на дентатность.
Наиб. распространенные координационные числа - 4 и 6, но известно много комплексов, центр. атом к-рых имеет координационные числа 2, 3, 5, 7, 8 и более.
Геометрическая конфигурация
Геометрическая конфигурация строения внутренней сферы комплексов бывает различной: линейная, треугольная, квадратная, тетраэдрическая, октаэдрическая, пирамидальная, бипирамидальная и т.д., в зависимости от природы центрального атома металла, лигандов, внешнесферного окружения. Структура комплексов экспериментально обычно устанавливается рентгеноструктурным и спектральными методами.
Изомерия комплексных соединений
Под изомерией понимают способность к разному взаимному расположению атомов и атомных фрагментов в соединениях одинакового общего состава, диктующую отличия в химических и физических свойствах соответствующих соединений — изомеров.
У комплексных соединений явление изомерии обусловлено:
различиями в строении и координации лигандов
различиями в строении внутренней координационной сферы
разным распределением частиц между внутренней и внешней сферой. Основные виды изомерии комплексных соединений – геометрическая, оптическая, сольватная (или гидратная), ионная и координационная.
Пространственная (геометрическая) изомерия
Этот вид изомерии вызван неодинаковым размещением лигандов во внутренней сфере относительно друг друга. Необходимым условием геометрической изомерии является наличие во внутренней координационной сфере не менее двух различных лигандов.
Оптическая изомерия
Оптическая изомерия связана со способностью некоторых комплексных соединений существовать в виде двух форм, не совмещаемых в трехмерном пространстве и являющихся зеркальным отображением друг друга, как левая рука и правая. Поэтому оптическую изомерию называют иногда ещё зеркальной изомерией.
Структурная изомерия
Гидратная (сольватная) изомерия заключается в различном распределении молекул растворителя между внутренней и внешней сферами комплексного соединения, в различном характере химической связи молекул воды с комплексообразователем.
Классическим примером гидратной изомерии является существование трех изомерных гидратов хлорида хрома(III) с общей формулой CrCl3 . 6 H2O.
Ионная изомерия
Ионизационная изомерия определяется различным распределением заряженных лигандов между внутренней и внешней сферами комплекса и характеризует способность координационных соединений с одним и тем же элементным составом давать в растворе разные ионы.
Пример ионных изомеров – бромид дихлоротетраамминплатины(IV) и хлорид дибромотетраамминплатины(IV):
[Pt(NH3)4Cl2]Br2 и [Pt(NH3)4Br2]Cl2
Координационная изомерия
Координационная изомерия связана с переходом лигандов от одного комплексообразователя к другому: [Co(NH3)6][Cr(CN)6] и [Cr(NH3)6][Co(CN)6].
2.
Вода
Вода́ (оксид водорода) — химическое вещество в виде прозрачной жидкости, не имеющей цвета (в малом объёме), запаха и вкуса (при стандартных условиях). Химическая формула: Н2O.
Электролитическая диссоциация воды
Вода представляет собой слабый амфотерный электролит:
Н2О
![]() Н+
+ ОН-
Н+
+ ОН-
или, более точно:
2Н2О Н3О+ + ОН-
Равновесие этой реакции сильно смещено влево. Константу диссоциации воды можно вычислить по формуле:
![]()
где:
[H+] — концентрация ионов гидроксония (протонов);
[OH−] — концентрация гидроксид-ионов;
[H2O] — концентрация воды (в молекулярной форме) в воде;
Константа диссоциации — вид константы равновесия, которая показывает склонность большого объекта диссоциировать (разделяться) обратимым образом на маленькие объекты, как например когда комплекс распадается на составляющие молекулы, или когда соль разделяется в водном растворе на ионы.
Концентрация воды в воде, учитывая её малую степень диссоциации, величина практически постоянная и составляет (1000 г/л)/(18 г/моль) = 55,56 моль/л.
При 25 °C константа диссоциации воды равна 1,8·10−16моль/л. Уравнение (1) можно переписать как:
![]()
Обозначим произведение K·[H2O] = Kв = 1,8·10−16 моль/л·55,56 моль/л = 10−14моль²/л² = [H+]·[OH−] (при 25 °C).
Константа Kв, равная произведению концентраций протонов и гидроксид-ионов, называется ионным произведением воды. Она является постоянной не только для чистой воды, но также и для разбавленных водных растворов веществ. C повышением температуры диссоциация воды увеличивается, следовательно, растёт и Kв, при понижении температуры — наоборот.
Водородный показатель
Водоро́дный показа́тель, pH — мера активности (в очень разбавленных растворах она эквивалентна концентрации) ионов водорода в растворе, и количественно выражающая его кислотность, вычисляется как отрицательный (взятый с обратным знаком) десятичный логарифм активности водородных ионов, выраженной в молях на литр:
![]()
Например, концентрация ионов водорода [H+] равна 10^-5 моль/л, то lg10^-5 = -5, a –lg10^-5 = 5 (^ это значит, что в степени). Значит, pH = 5
На всякий случай, pH + pOH=14 ==> pOH = 14 -5 = 9
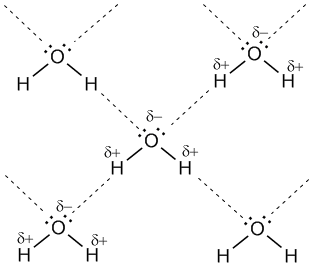
Водородная связь
Водородная связь, вид химического взаимодействия атомов в молекулах, отличающийся тем, что существенное участие в нём принимает атом водорода (Н), уже связанный ковалентной связью с другим атомом (А). Группа А — Н выступает донором протона (акцептором электрона), а другая группа (или атом) В — донором электрона (акцептором протона). Иначе говоря, группа А — Н проявляет функцию кислоты, а группа В — основания. Для обозначения водородной связи употребляют, в отличие от обычной валентной чёрточки, пунктир, т. е. А — Н···В
Наиболее известный пример соединения с водородной связью-это вода.
3.
H2S + 2HNO3 = S + 2NO2 (NO) + 2H2O ( не уверен)
BaCO3 + H2SO4 = BaSO4 + CO2 + H2O
№19
1.
