
- •Соединения азота
- •2. Физико-химические основы и аппаратурное оформление процессов высокотемпературной фиксации атмосферного азота.
- •Термический метод
- •3 Теоретические основы получения низких температур
- •4Теоретические основы криогенной техники. Холодильные циклы. Технологические схемы н оборудование воздухе разделительных установок.
- •5. Теоретические основы разделения жидкого воздуха на азот и кислород. Устройство ректификационной установки.
- •7.Обзор и сравнение способов получения водорода
- •8 Газификация твердого топлива
- •9. Конверсия водяным паром
- •10. Основы конверсии природного газа кислородом и смесью окислителей. Оптимальный температурный режим.
- •11. Методы очистки газов от каталитических ядов. Очистка природного газа от сернистых соединений.
- •12.Технологическая схема 2-х ступенчатой каталитической конверсии природного газа под давлением 3-4 мПа.
- •13 Типовое оборудование стадии конверсии:
- •14.Устройство конверторов оксида углерода. Полочные, аксиальные и радиальные конверторы.
- •Аксиальный двухполочный конвертор.
- •Радиальный двухполочный конвертор.
- •17. Очистка конвертируемого газа от со2
- •Очистка конвертируемого газа р-рами на основе водных этанол-аминов.
- •Очистка конвертируемого газа водными р-рами карбонатов щелочных Ме
- •18. Физико-химические основы синтеза nh3. Равновесие и кинетика процесса. Виды катализаторов.
- •19. Обоснование оптимального режима синтеза аммиака
- •20. Промышленые способы синтеза амиака.Принцип.Схемы
- •21. Технологическая схема синтеза аммиака в агрегатах большой единичной мощности
- •22 Устройство колонны синтеза аммиака с полочной насадкой.
- •24 Физико-химические основы контактного окисления аммиака. Виды катализаторов. Оптимальный технологический режим.
- •26. Абсорбция оксидов азота осуществляется водой:
- •27Промышленые способы получения азотной кислоты
- •29. Методы обезвреживания хвостовых нитрозных газов в производстве азотной кислоты
- •30 Способы получения концентрированной азотной кислоты. Технологическая схема получения концентрированной азотной кислоты методом выпарки с водоотнимающимисредствами.
- •31. Прямой синтез конц. Hno3 из оксида азота
- •32.Вида азотных удобрений
- •Сульфат аммония
- •Аммонийной селитры
- •Карбамид
- •34. Физико-химические основы нейтрализации азотной кислоты аммиаком. Аппаратурное оформление процесса. Устройство оборудования.
- •35.Выпарка растворов аммиачной селитры. Гранулирование плава аммиачной селитры. Устройство основного оборудования.
- •36 Технологическая схема производства аммонийной селитры в ас-72
- •37. Физико-химические основы процесса синтеза
- •39.Технологическая схема карбамида с полным жидкостным рециклом.
- •40Технологическая схема производства карбамида (стрипинг процесс)
11. Методы очистки газов от каталитических ядов. Очистка природного газа от сернистых соединений.
Опасность представляют сернистые соединения (меркаптаны, тиосульфаты), все кислородсодержащие соединения (кислород, водяной пар). Существует 4 метода очистки:
абсорбционный основан на селективном поглощении вредных примесей жидкими поглотителями за счет физической абсорбции и хемосорбции; регенерация путем нагрева; на 1 ступени абсорбция при низких температурах, затем после насыщенный раствор подается на регенерацию;
адсорбционный селективное поглощение твердым поглотителем за счет физической адсорбции или хемосорбции; физическая адсорбция представляет собой обратимый процесс, а хемосорбция – необратимый; в качестве поглотителей используют активированный уголь, цеолиты; поглотитель регенерируется нагреванием; для достаточно высокой степени поглощения добавляют вещества с высокой химической активностью;
каталитический превращение вредных примесей в инертные соединения,
креогенный конденсация вредных примесей при их охлаждении до низких температур (вымораживание);
Fe(OH)3 + H2S = Fe2S3 + H2O
Fe2S3 + O2 = Fe2O3 + S
Адсорбция сернистых соединений осуществляется углем. Вымывается полисульфидом аммония. В качестве жидких поглотителей сода, оксэтиломышьяковистых солей.
Na3AsS3O + H2S = Na3AsS4 + H2O
(поглощает H2S)
Регенерация: Na3AsS4 + 0,5O2 = Na3AsS3O + S
Для очистки природного газа от сернистого соединения: 1стадия – превращение труднорастворимых соединений в легкорастворимые, превращение в H2S. Природный газ + АВС(содержание H2 около 10%).
CS2 + 4H2 = CH4 + 2H2S
COS + H2 = CO + H2S
RSH + H2 = RH + H2S
Все сернистые соединения превращаются в сероводород.
ZnO + H2S = ZnS + H2O (T=300-400 0C)
В качестве поглотителя гранулируют ZnO, загружают в аппарат шахтного типа:

Промышленные схемы отличаются по величине P и виду окислителей (водяной пар, кислород).
Схема 1: осуществляется при P близкому к атмосферному; в качестве окислителей используется смесь водяного пара с воздухом, обогащенном кислородом; получается АВС стехиометрического состава, чтобы обеспечить автотермичность, необходимо обеспечить смесь воздуха, обогащенного кислородом, такие установки малоинтенсивны, не в полной мере используется тепло экзотермических реакций;
Схема 2: окисление кислорода автотермичность (раздел. установки);
Схема 3: окисление смесью водяного пара с кислородом; для интенсификации увеличивают P до 3 МПа
12.Технологическая схема 2-х ступенчатой каталитической конверсии природного газа под давлением 3-4 мПа.
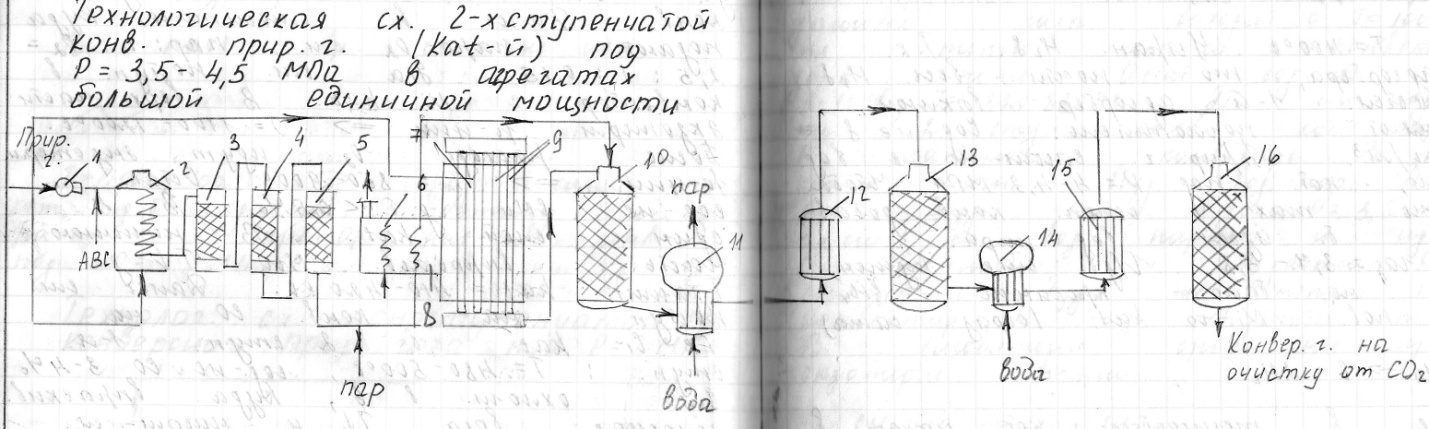
1-компрессор;2-подогреватель;3-аппарат для кат-го гидрирования сернистых соеденений;4,5-адсорберы Н2S;6-теплообменники для подогрева исх.компонентов;7-р-ционная печь;8-конвективная зонар-цион. Печи;9-
10-шахтный конвектор природного газа;11-котел утилизатор;12-теплообменник;13-конвектор СО 1-й ступени;14- котел утилизатор;15- теплообменник;16- конвектор СО 2-й ступени;
Техн. Газ поступает с P=0,2МПа и дел-ся на 2 потока:1)на техн.нужды 2)на подогрев аппарата.При мощности агрегата 1300т/сутки V прир-го.газа на техн. Нужды=40 тыс. норм м3/ч.Прир-й газ зжим-ся в компрессоре до P=4-4,5МПа. Газ смеш-ся с АВС,чтобы осущиствить процесс кат-го гидрирования.
СS2+4H2=CH4+H2S ; СOS+H2=CO+H2S
H22д.б. 10% от V прир-го газа.
Далее в 2,где нагр-ся до 400градусов. Гидрир-е идет на AI-Co-Ni kat,оптим. V-а =1000н.м3 сух.г/м3 час—отсюда Vkat=40 м3. Потом 2 послед. адс-я с гранулированным ZnO : ZnO+H2S=ZnS+H2O
Тут Т=400. Устран. H2S. Т.к 2 адсорбера, то почти весь H2Sудал-ся.1-й адсорбер выключ.,замен-ют поглотитель. Сод-ие S=0,5мг/м3.Прир-й газ смеш-ся с вод.паром,кот. Под P=4-4,2 МПа. Чтобы достич max степ. Конв. Добавляют б.избыток вод.пара.Пар:газ=3,7-3,8.Изб.еще нужен,чтобы небыло крекинга СH4 на пов-ти с-го kat : СH4=C+2H2
Далее в теплообменник кот. Наход. В конвективной зоне труб. Печи Там блок теплообмен-в.,кот. Нагрев. За счет сжиг. прир-го газа в межтруб. Простр. Трубчатой печи. Паро-газ.смесь нагрев. До Т=520-550 и поступ. на 1 ступ. конв. с вод. Паром : СH4+H2O=CO+3H2 Реак-я с. Экзотермическая, т.е. надо см. нагрев-ть до Т=800-900. Р-ция на Ni-м kat. V kat=20м3. Конт.аппарат-труба с kat.Трубы из огнеупор.высоколегиров.стали. Д=114х21----д.б=5км.Это невозможно, поэтому многорядная труб.печь.12 рядов с L=11м,в каждом ряду42 трубы. Вверху коллектор,где вварены трубы.Прир.газ равномерно пост-т во все трубы..Т д.б. 800-900. Для этого в межтр. Прос-ве сжиг-ся прир.газ.Наруж. стенка 1000 град.Образ. дымовые газы выходят с Т=1000,их тепло испо-ся в конвективной зоне печи. Остат. Содер-е СH4 9-10%?N=820-830Эта см. пода-ся на 2 ступень конверсии, кот. Осущ-ся в шахтном конвекторе.В кач. окисл. исп-ся возд+вод.пар.Для этого возд. сжим. До P=3,5-4МПа,смеш. С вод.паром и идет в теплообменник и под-ся в смеситель.Туда же непрер. под-ся конвект.газ из труб. печи.В смеситель сразу же идутэкзотерм.р-ции: СH4+2O2=CO+3H2; 2H2+O2=2H2O; 2CO+O2=2CO
В верхней части реактора идут только экзот. р-ции –т.е.Т увел. до 1100-1200.После израсх-ия O2 идут эндот. р-ции---т.е Т уменьш-ся.На выходе из конвектора Т=950-1000.Кол-во возд. д.б. таким, чтобы N2:H2 после очистки от CO2=1:3. Конв. завер-ся. Остаточное содер-е СH4 д.б. <0,5%.Это достиг. За счет оптим. техн. режима.Оптим. V-ая скорость= 3000 н.м3 сух.г/м3час. Vkat=40 м3 Далее смесь идет на конверсию CO Р-ция экзотерм. СO+H2O=CO2+H2
Надо уменьшать Т. Конверсия в 2 ступени:1)Fe-Cr kat,2)Zn-Cr-Cu kat. Тзаж. 1-го=400. А у нас на вых. Из конвектора 1000. Зн. надо охлодить. после шахтного конвектра устан-ся котлы утилизаторы где хлаж-ся см.до Тзаж kat и получ-ся пар с Р=10,2МПа. После см.поступает на 1 ступ.конверсии.Оптим.V-я скорость=2000, Vkat 100м3 Т.к р-ция экзот., то мере движ. см. Т увел. до 500. При увел Т равн. р-ции смещ-ся в обр. направление .Зн. надо см. охлаждать .Остат. сод. СО=3,5-4%.Этот газ подают на 2 ступень.Тзаж=180-200.Смесь охлажд. В котле утилизаторе.Ост.сод-е СО=д.б<0,3-0,5%, Т=200-220. Этот г.подается на очистку от ок.,а затем на синтез аммиака.
++++Достоинство
1)увел.Р=4МПа-----процесс сталболее интенсивней
2)нет необход.воздухоразделит.установки
3)max ип-ся теплота экзот.р-циий с пом котлов утилиз.
4)Выр-ся вод.пар с З=10,2МПа(уменьшается расход элек.энергии)
-------Недостатки
1)б. избыток вод.пара.Этот пар в р-ции не участв.Его нагрев. до >.Т –затраты энергии.
Для умен-я затрат энергии в соврем.схемах пытаются умен-ть изб.вод.пара
Пар : газ=2,5-2,8. Но Ссн4 увел-ся до 15-16% на вых. Из трубчатой печи. Также увел-т кол-во возд.,чтобы увеличить степень конверсии на 2 ступени.
