
- •Соединения азота
- •2. Физико-химические основы и аппаратурное оформление процессов высокотемпературной фиксации атмосферного азота.
- •Термический метод
- •3 Теоретические основы получения низких температур
- •4Теоретические основы криогенной техники. Холодильные циклы. Технологические схемы н оборудование воздухе разделительных установок.
- •5. Теоретические основы разделения жидкого воздуха на азот и кислород. Устройство ректификационной установки.
- •7.Обзор и сравнение способов получения водорода
- •8 Газификация твердого топлива
- •9. Конверсия водяным паром
- •10. Основы конверсии природного газа кислородом и смесью окислителей. Оптимальный температурный режим.
- •11. Методы очистки газов от каталитических ядов. Очистка природного газа от сернистых соединений.
- •12.Технологическая схема 2-х ступенчатой каталитической конверсии природного газа под давлением 3-4 мПа.
- •13 Типовое оборудование стадии конверсии:
- •14.Устройство конверторов оксида углерода. Полочные, аксиальные и радиальные конверторы.
- •Аксиальный двухполочный конвертор.
- •Радиальный двухполочный конвертор.
- •17. Очистка конвертируемого газа от со2
- •Очистка конвертируемого газа р-рами на основе водных этанол-аминов.
- •Очистка конвертируемого газа водными р-рами карбонатов щелочных Ме
- •18. Физико-химические основы синтеза nh3. Равновесие и кинетика процесса. Виды катализаторов.
- •19. Обоснование оптимального режима синтеза аммиака
- •20. Промышленые способы синтеза амиака.Принцип.Схемы
- •21. Технологическая схема синтеза аммиака в агрегатах большой единичной мощности
- •22 Устройство колонны синтеза аммиака с полочной насадкой.
- •24 Физико-химические основы контактного окисления аммиака. Виды катализаторов. Оптимальный технологический режим.
- •26. Абсорбция оксидов азота осуществляется водой:
- •27Промышленые способы получения азотной кислоты
- •29. Методы обезвреживания хвостовых нитрозных газов в производстве азотной кислоты
- •30 Способы получения концентрированной азотной кислоты. Технологическая схема получения концентрированной азотной кислоты методом выпарки с водоотнимающимисредствами.
- •31. Прямой синтез конц. Hno3 из оксида азота
- •32.Вида азотных удобрений
- •Сульфат аммония
- •Аммонийной селитры
- •Карбамид
- •34. Физико-химические основы нейтрализации азотной кислоты аммиаком. Аппаратурное оформление процесса. Устройство оборудования.
- •35.Выпарка растворов аммиачной селитры. Гранулирование плава аммиачной селитры. Устройство основного оборудования.
- •36 Технологическая схема производства аммонийной селитры в ас-72
- •37. Физико-химические основы процесса синтеза
- •39.Технологическая схема карбамида с полным жидкостным рециклом.
- •40Технологическая схема производства карбамида (стрипинг процесс)
29. Методы обезвреживания хвостовых нитрозных газов в производстве азотной кислоты
Обезвреживание нитрозных газов от примесей осуществляется: абсорбцией, адсорбцией, католит. для разных инертных примесей. В качестве поглотителя используются водные и солевые растворы.
2NO2 + H2O = HNO3 + HNO2
Na2CO3 + 2 HNO3 = 2NaNO3 + CO2
Na2CO3 + 2 HNO2 = 2NaNO2 + CO2
Устанавливают окислительную башню. В результате абсорбции получается нитрит нитратный щелок.
NaNO2 + HNO3 = NaNO3 + HNO2
При выборе абсорбента лучше переводить в труднолетучие соединения, процесс абсорбции является обратимым.
трибутилфосфат + nNO2↔ТБФ·n NO2
Адсорбционный метод: регенерация путем нагрева.
Каталитический метод: каталитическое восстановление до элементарного азота; (окислит.) восстановление оксидов азота – природный газ, газообразный аммиак.
CH4 + 2O2 = CO2 + 2H2O + Q
CH4 + 0.5O2 = CO + 2H2 + Q
4NO + CH4 = CO2 + 2H2O + 2N2
NO + H2 = 0.5 N2 + H2O
CO + NO = CO2 + 0.5 N2
Токсичные элементы из хвостовых нитрозных газов убираются восстановлением на катализаторе (Ме платиновые группы Al-Pd катализаторы). Tз.к. = 400 0С, рабочий интервал температур 700-800 0С. Чтобы произошло восстановление нитрозные газы подогревают до 400 0С, смешивают с природным газом (количество рассчитывается). Хвостовые газы выбрасываются в атмосферу.
Недостаток: природный газ расходуется не только на восстановление, но и на выжигание кислорода, более предпочтительно использовать газы, не реагирующие с кислородом. Для селективного восстановления применяется Al – Va катализаторы, применяются в гранулированном виде.
30 Способы получения концентрированной азотной кислоты. Технологическая схема получения концентрированной азотной кислоты методом выпарки с водоотнимающимисредствами.
Способы получения концентрированной азотной кислоты:
1 Методом выпарки
2 Методом прямого синтеза
Дисцилляция
разбавленных водных растворов азотной
кислоты позволяет концентрировать ее
до содержания 60 – 65% .
Только введением в разбавленную
водоотнимающих средств можно повысить
давление насыщенных паров
и осуществить отгонку концентрированной
.
Температуры кипения растворов серной
кислоты значительно выше температур
кипения концентрированной
,
поэтому при дисцилляции в парах будет
находиться
,
а в кубовом остаткеq
– водный раствор серной кислоты.
Концентрирование разбавленных растворов
с помощью серной кислоты осуществляется
в колоннах барботажного типа. Выделяющиеся
в этих аппаратах пары
конденсируются в холодильнике, охлождаемом
водой, а разбавленная серная кислота
после денитрации поступает на упаривание
до концентрации 93% и снова используется
для концентрирования разбавленной
.
Серная кислота циркулирует в замкнутом
цикле.
.
Только введением в разбавленную
водоотнимающих средств можно повысить
давление насыщенных паров
и осуществить отгонку концентрированной
.
Температуры кипения растворов серной
кислоты значительно выше температур
кипения концентрированной
,
поэтому при дисцилляции в парах будет
находиться
,
а в кубовом остаткеq
– водный раствор серной кислоты.
Концентрирование разбавленных растворов
с помощью серной кислоты осуществляется
в колоннах барботажного типа. Выделяющиеся
в этих аппаратах пары
конденсируются в холодильнике, охлождаемом
водой, а разбавленная серная кислота
после денитрации поступает на упаривание
до концентрации 93% и снова используется
для концентрирования разбавленной
.
Серная кислота циркулирует в замкнутом
цикле.
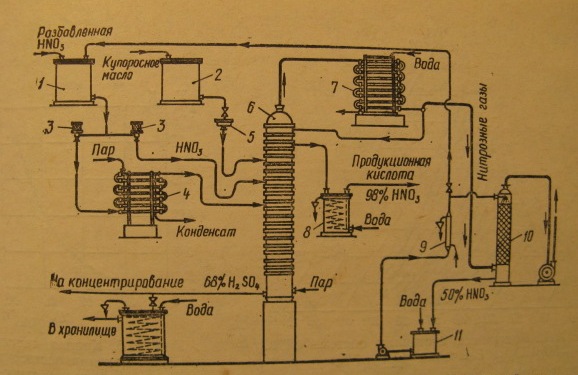
Разбавленная из напорного бака 1 направляется в колонну 6 через два фонаря-расходомера 3, включенных параллельно. Часть кислоты проходит испаритель 4 и в виде парожидкостной смеси поступает на десятую тарелку колонны, остальная кислота подается на три тарелки выше. Под первую тарелку колонны поступает острый пар для денитрации отработанной серной кислоты. Пары отводятся через штуцер в крышке колонны и конденсируются в холодильнике 7. Образующаяся кислота содержит большое количество растворенных оксидов азота и потому возвращается на верхнюю тарелку колонны 6, где продувается парами , идущими из колонны в конденсатор. Пройдя две отбелочные тарелки, концентрированная кислота, освобожденная от оксидов азота, отводится из колонны 6 и после охлаждения в холодильнике 8 поступает на склад. Часть паров , не сконденсировавшихся в холодильнике 7, в смеси с оксидами азота и воздухом, приникающим в систему через неплотности в аппаратуре, поглощается водой в башне 10, где образуется 50%-й раствор , который охлаждаясь затем в холодильнике 9, поступает в сборник 11. Отработанная серная кислота на выходе из колонны 6 направляется на концентрирование. Температура паров на выходе из колонны 6 равна 358К, после конденсатора 7 – около 303 К. Давление перегретого пара на входе в колонну не превышает 0,15МПа, его температура равна 520К. Давление насыщенного пара, поступающего пара, поступающего в испаритель 4, составляет 0,4 – 0,6 МПа.
