
- •Соединения азота
- •2. Физико-химические основы и аппаратурное оформление процессов высокотемпературной фиксации атмосферного азота.
- •Термический метод
- •3 Теоретические основы получения низких температур
- •4Теоретические основы криогенной техники. Холодильные циклы. Технологические схемы н оборудование воздухе разделительных установок.
- •5. Теоретические основы разделения жидкого воздуха на азот и кислород. Устройство ректификационной установки.
- •7.Обзор и сравнение способов получения водорода
- •8 Газификация твердого топлива
- •9. Конверсия водяным паром
- •10. Основы конверсии природного газа кислородом и смесью окислителей. Оптимальный температурный режим.
- •11. Методы очистки газов от каталитических ядов. Очистка природного газа от сернистых соединений.
- •12.Технологическая схема 2-х ступенчатой каталитической конверсии природного газа под давлением 3-4 мПа.
- •13 Типовое оборудование стадии конверсии:
- •14.Устройство конверторов оксида углерода. Полочные, аксиальные и радиальные конверторы.
- •Аксиальный двухполочный конвертор.
- •Радиальный двухполочный конвертор.
- •17. Очистка конвертируемого газа от со2
- •Очистка конвертируемого газа р-рами на основе водных этанол-аминов.
- •Очистка конвертируемого газа водными р-рами карбонатов щелочных Ме
- •18. Физико-химические основы синтеза nh3. Равновесие и кинетика процесса. Виды катализаторов.
- •19. Обоснование оптимального режима синтеза аммиака
- •20. Промышленые способы синтеза амиака.Принцип.Схемы
- •21. Технологическая схема синтеза аммиака в агрегатах большой единичной мощности
- •22 Устройство колонны синтеза аммиака с полочной насадкой.
- •24 Физико-химические основы контактного окисления аммиака. Виды катализаторов. Оптимальный технологический режим.
- •26. Абсорбция оксидов азота осуществляется водой:
- •27Промышленые способы получения азотной кислоты
- •29. Методы обезвреживания хвостовых нитрозных газов в производстве азотной кислоты
- •30 Способы получения концентрированной азотной кислоты. Технологическая схема получения концентрированной азотной кислоты методом выпарки с водоотнимающимисредствами.
- •31. Прямой синтез конц. Hno3 из оксида азота
- •32.Вида азотных удобрений
- •Сульфат аммония
- •Аммонийной селитры
- •Карбамид
- •34. Физико-химические основы нейтрализации азотной кислоты аммиаком. Аппаратурное оформление процесса. Устройство оборудования.
- •35.Выпарка растворов аммиачной селитры. Гранулирование плава аммиачной селитры. Устройство основного оборудования.
- •36 Технологическая схема производства аммонийной селитры в ас-72
- •37. Физико-химические основы процесса синтеза
- •39.Технологическая схема карбамида с полным жидкостным рециклом.
- •40Технологическая схема производства карбамида (стрипинг процесс)
24 Физико-химические основы контактного окисления аммиака. Виды катализаторов. Оптимальный технологический режим.
В результате окисления могут образовываться различные продукты в зависимости от условий:
4NH3+5O2=4NO+6H2O+90,7кДж(1); 4NH3+4O2=2N2O+6H2O+1104,4кДж(2); 4NH3+3O2=2N2+6H2O+1269кДж(3); Все реакции идут при повышенной Т => могут быть и побочные реакции
Необходимо подобрать условия, чтобы протекала только 1-я реакция. т. к. только она может привести к образ HNO3. Все реакции являются сильно экзотермическими и необратимыми
Кр1=10-53, Кр2=10-61, Кр3=10-67
=>Наиболее вероятной является 3-я реакция, но она приводит к образованию элементарного азота. Если осуществлять процесс без катализатора, то продуктом окисления будет элементарный азот. Чтобы получить 1-ю реакцию, необходимо подобрать селективный и активный катализатор, который будет ускорять 1-ю реакцию.
Таким является катализатор на основе металлической Pt. Применяют катализаторы: Fe,Cr,Co,Mn. Все эти катализаторы по селективности, активности, сроку службы уступают Pt-му катализатору.
Время контакта газ смеси с катализатором 10-4сек, выход NO 98% - на других катализаторах этого
слоем неPt-го катализатора. Pt-вый kat чувствительный к примесям.Наиболее отравляющее действие оказывает PH3,H2S,сернистые соединения,SO2,механические загрязнения из воздуха и NH3.Воздух и NH3 подвергают очисткеот неорганических соединений и от пыли. Очистка от соединений S достичь нельзя. Применяют тонкую Pt-ую проволоку d=0,045-0,094мм. Чтобы достичь времени контактирования 10-4сек устанавливают несколько таких сеток.
(-) kat При Т=800-9000 происходит разрушение Pt-го kat. Нити из проволоки разрыхляются и происходит унос Pt с поверхности катализатора вместе с нитрозными газами. Необходимо улучшать физ-хим свойства Pt-вой проволоки(термоустойчивость,прочность), т.е. надо вводить легирующие добавки. Используют не чистую Pt, а сплавы Pt с различными легирующими элементами(Co,V,Mo,W,Mn,Ni), которые ↑ прочность и термоустойчивость.Могут Pt-вые сплавы содержать Rh,Pd,Ro,Ru. Это позволяет ↓ потери Pt, ↑селективность окисления на 2-3% выше, чем на чистой Pt. Обнаруживают большое кол-во оксидов kat: Co2O3,Fe2O3,Cr2O3,MnO2, но они существенно уступают Pt-вым, они быстро теряют свою активностьть. В промышленных условиях наибольшее распространение получили комбинированные катализаторы, в которых часть Pt-вых сеток заменены осуществляется абсорбцией водой
Механизм окисления: 4NH3+5O2=4NO+6H2O- это суммарная реакция, а процесс окисления состоит из большого числа стадий:
1)диффузия реагирующих веществ из объема газовой фазы к поверхности kat.
2)активированная адсорбция NH3 и О2 на поверхности kat
3)Химическое взаимодействие с образованием на поверхности kat оксидов азота и воды
4)десорбция с поверхности kat
5)диффузия с поверхности kat в реакционную среду
Чтобы выявить lim стадию проводят исследования: при недостатке О2 или при стехиометрическом соотношении lim является стадия адсорбции О2; при избытке О2 lim является диффузия молекул NH3 к поверхности kat.
Выход NO при окислении NH3 кислородом зависит:
- от Т газовой смеси;
- от времени контакта;
- от соотношения реагирующих компононтов;
- от давления;
В лияние
Т.
Процесс надо вести с kat=>
Т зависит от Тзаж
и его термоустойчивости. Тзаж(Pt)=2000:
реакция окисления начинается при такой
Т. При меньшей Т основной продукт
окисления – N2O;
NO
будет при Т>2500.При
↑ Т выход ↑. Max
выход при 800-9000-
98%.100% не может быть, т.к. протекает побочные
реакции с образованием N2O
лияние
Т.
Процесс надо вести с kat=>
Т зависит от Тзаж
и его термоустойчивости. Тзаж(Pt)=2000:
реакция окисления начинается при такой
Т. При меньшей Т основной продукт
окисления – N2O;
NO
будет при Т>2500.При
↑ Т выход ↑. Max
выход при 800-9000-
98%.100% не может быть, т.к. протекает побочные
реакции с образованием N2O
Оптимальный режим 800-9000 => реакционную смесь перед аппаратом надо подогревать. Max выход при 900-9200, но при ↑ Т будут потери Pt kat => процесс надо вести при Т=8000 (под Ратм). В системах с повышенным Р используют ↑ Т. В наст время Р=0,4-0,8МПа, это требует ↑ Т до 800-8500
С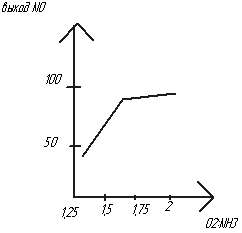 оотношение
NH3
и O2.
4NH3+5O2=4NO+6H2O
– Окисление проводят не чистым О2,
а воздухом(21% О2),
т.е. по уравнению на 1 моль NH3
должно быть 1,25 моль О2.
При стехиометрическом соотношении
выход NO
↓. Чтобы выход был ↑ берут избыток О2
=> изб О2
должен быть 1,7-2(по графику) – СNH3
всегда будет < теоретического
СNH3=10,5-12%.
Смесь NH3
с воздухом взрывоопасна. СNH3
не должна быть=16-25%.
оотношение
NH3
и O2.
4NH3+5O2=4NO+6H2O
– Окисление проводят не чистым О2,
а воздухом(21% О2),
т.е. по уравнению на 1 моль NH3
должно быть 1,25 моль О2.
При стехиометрическом соотношении
выход NO
↓. Чтобы выход был ↑ берут избыток О2
=> изб О2
должен быть 1,7-2(по графику) – СNH3
всегда будет < теоретического
СNH3=10,5-12%.
Смесь NH3
с воздухом взрывоопасна. СNH3
не должна быть=16-25%.
Время контакта реагирующих компонентов с kat.
П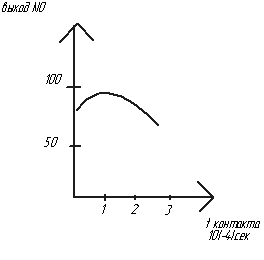 ри
малом времени контактирования NH3
не успевает адсорбироваться на kat
и часть молекул проскакивает за kat-кую
сетку, за которой идет взаимодействие.
Выход NO
↓ при ↑ врем контактир, т.к. молекулы
NH3
в зоне ↑ Т могут взаимодействовать с
О2
еще до поступления на сетку.
ри
малом времени контактирования NH3
не успевает адсорбироваться на kat
и часть молекул проскакивает за kat-кую
сетку, за которой идет взаимодействие.
Выход NO
↓ при ↑ врем контактир, т.к. молекулы
NH3
в зоне ↑ Т могут взаимодействовать с
О2
еще до поступления на сетку.
Влияние Р. 4NH3+5O2=4NO+6H2O+Q- ↑Р приводит к ↓ выхода NO, при ↑ Р ↑СNH3 за счет ↓ V, ↑ ρ газовой смеси. Т.к. образуется NO только на поверхности kat, то время, необходимое для окисления NH3 ↑, т.к. каждая молекула NH3 должна адсорбироваться на kat. Чтобы компенсировать ↓ выхода NO
н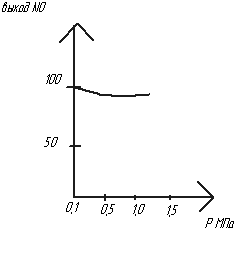 адо
↑ Т, а это влечет потери kat.
Оптим Р=0,35МПа. ↑ Р ведет к ↑ интенсивности,
↑ размеров аппарата, но и ведет к ↑ Т.
Агрегаты АК-72 позволяют снизить Т.
адо
↑ Т, а это влечет потери kat.
Оптим Р=0,35МПа. ↑ Р ведет к ↑ интенсивности,
↑ размеров аппарата, но и ведет к ↑ Т.
Агрегаты АК-72 позволяют снизить Т.
