
- •Соединения азота
- •2. Физико-химические основы и аппаратурное оформление процессов высокотемпературной фиксации атмосферного азота.
- •Термический метод
- •3 Теоретические основы получения низких температур
- •4Теоретические основы криогенной техники. Холодильные циклы. Технологические схемы н оборудование воздухе разделительных установок.
- •5. Теоретические основы разделения жидкого воздуха на азот и кислород. Устройство ректификационной установки.
- •7.Обзор и сравнение способов получения водорода
- •8 Газификация твердого топлива
- •9. Конверсия водяным паром
- •10. Основы конверсии природного газа кислородом и смесью окислителей. Оптимальный температурный режим.
- •11. Методы очистки газов от каталитических ядов. Очистка природного газа от сернистых соединений.
- •12.Технологическая схема 2-х ступенчатой каталитической конверсии природного газа под давлением 3-4 мПа.
- •13 Типовое оборудование стадии конверсии:
- •14.Устройство конверторов оксида углерода. Полочные, аксиальные и радиальные конверторы.
- •Аксиальный двухполочный конвертор.
- •Радиальный двухполочный конвертор.
- •17. Очистка конвертируемого газа от со2
- •Очистка конвертируемого газа р-рами на основе водных этанол-аминов.
- •Очистка конвертируемого газа водными р-рами карбонатов щелочных Ме
- •18. Физико-химические основы синтеза nh3. Равновесие и кинетика процесса. Виды катализаторов.
- •19. Обоснование оптимального режима синтеза аммиака
- •20. Промышленые способы синтеза амиака.Принцип.Схемы
- •21. Технологическая схема синтеза аммиака в агрегатах большой единичной мощности
- •22 Устройство колонны синтеза аммиака с полочной насадкой.
- •24 Физико-химические основы контактного окисления аммиака. Виды катализаторов. Оптимальный технологический режим.
- •26. Абсорбция оксидов азота осуществляется водой:
- •27Промышленые способы получения азотной кислоты
- •29. Методы обезвреживания хвостовых нитрозных газов в производстве азотной кислоты
- •30 Способы получения концентрированной азотной кислоты. Технологическая схема получения концентрированной азотной кислоты методом выпарки с водоотнимающимисредствами.
- •31. Прямой синтез конц. Hno3 из оксида азота
- •32.Вида азотных удобрений
- •Сульфат аммония
- •Аммонийной селитры
- •Карбамид
- •34. Физико-химические основы нейтрализации азотной кислоты аммиаком. Аппаратурное оформление процесса. Устройство оборудования.
- •35.Выпарка растворов аммиачной селитры. Гранулирование плава аммиачной селитры. Устройство основного оборудования.
- •36 Технологическая схема производства аммонийной селитры в ас-72
- •37. Физико-химические основы процесса синтеза
- •39.Технологическая схема карбамида с полным жидкостным рециклом.
- •40Технологическая схема производства карбамида (стрипинг процесс)
19. Обоснование оптимального режима синтеза аммиака
Влияние давления.
И термодинамические, и кинетические факторы свидетельствуют в пользу проведения процесса при высоких давлениях (увеличивается равновесный выход, повышается скорость синтеза).
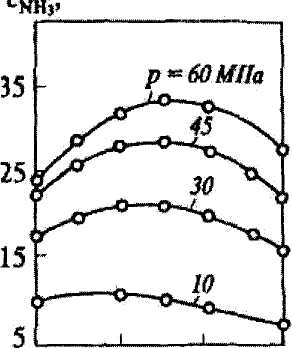
На рис. 3.1. приведены зависимости содержания аммиака в азотоводородной смеси стехиометрического состава от давления для промышленного катализатора марки СА-1.
Зависимость содержания аммиака при разных давлениях и объемной скорости 30000 ч-1.
 ,%(по-объему)
,%(по-объему)
400
450 500 t,*C
Рис
3.1.
Из рисунка видно, что с увеличением давления содержание аммиака увеличивается.
На ОАО "Гродно Азот" синтез аммиака осуществляется при давлении порядка 20 МПа.
Влияние объемной скорости.
Зависимость содержания аммиака на выходе из колонны синтеза для давления 30 МПа представлена в таблице 3.2.
Таблица 3.2.
Зависимость содержания аммиака на выходе из колонны синтеза
Объемная скорость, ч-1 |
Содержание аммиака при температуре, об. % |
||||||
400°С |
425°С |
450°С |
475°С |
500°С |
525°С |
550°С |
|
15000 |
21,3 |
23,8 |
24,6 |
23,6 |
22,1 |
19,3 |
16,2 |
30000 |
16,8 |
19,3 |
20,7 |
20,8 |
19,7 |
17,5 |
15,3 |
60000 |
12,7 |
15 |
16,7 |
17,3 |
17,1 |
15,7 |
13,9 |
120000 |
9,1 |
11,2 |
12,7 |
13,7 |
13,9 |
13,2 |
12,1 |
При увеличении объемной скорости удельная производительность катализатора возрастает, следовательно, увеличивается производительность колонны синтеза (съем аммиака с 1 м3 катализатора увеличивается). При этом концентрация аммиака уменьшается, пропорционально падает скорость обратной реакции, а скорость суммарного процесса увеличивается. Однако увеличение объемной скорости отрицательно скажется на системе конденсации аммиака (расход холода увеличится).
На ОАО "Гродно Азот" объемная скорость составляет порядка 17000-19000 ч-1.
Влияние температуры.
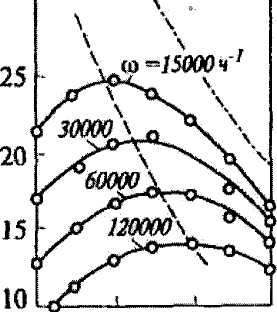
Зависимость содержания аммиака от температуры при разных объемных скоростях и давлении 30 МПа представлена на рис 3.2.
Из рисунка видно, что для синтеза аммиака существует оптимальный интервал температур. Процесс синтеза надо начинать при более высокой температуре, а затем снижать температуру по линии оптимальных температур (процесс синтеза необходимо осуществлять в падающем температурном режиме).
Зависимость содержания аммиака от температуры при разных объемных скоростях и давлении 30 МПа
, % (по объему)
400 450 500 t,ºC
Рис 3.2.
На ОАО "Гродно Азот" рабочий интервал температур 400-530°С.
Влияние инертов.
Введение инертного газа в систему при р = const подобно эффекту уменьшения общего давления. Реакция протекает с уменьшением числа молей (Δn< 0), разбавление инертным газом смещает равновесие реакции в сторону исходных реагентов.
Для синтеза аммиака увеличение концентрации инертов в газе будет приводить к уменьшению парциального давления азотоводородной смеси, что равносильно снижению давления в системе, а это приведет к уменьшению концентрации аммиака на выходе.
Выводы о влиянии инертного газа непосредственно следуют и из закона Дальтона:
Pj=Nj·p
где Pj - парциальное давлениеj-ro компонента;
Nj· мольная доля j-ro компонента.
Из закона Дальтона видно, что эффект разбавления подобен эффекту снижения общего давления в системе.
