- •Пространственно-временные(физические) системы отсчета. Способы задания положения материальной точки. Относительность движения. Кинематические характеристики движения.
- •Ускорение материальной точки. Нормальное и тангенциальное ускорение.
- •Закон инерции Галилея. Инерциальные системы отсчета. Принцип относительности Галилея. Преобразования Галилея.
- •5) Закон изменения импульса. Сила. Второй и третий законы Ньютона.
- •6) Момент импульса. Закон сохранения момента импульса.
- •Потенциальная энергия. Связь силы и потенциальной энергии.
- •Кинетическая энергия поступательного и вращательного движения тела. Закон сохранения и изменения механической энергии.
- •12. Неинерциальные системы отсчета. Силы инерции.
- •Преобразования Лоренца.
- •Импульс в сто.
- •Основные положения молекулярно-кинетической теории и их опытное обоснование.
- •Скорость теплового движения молекул. Опыт Штерна..
- •Основное уравнение мкт в форме Клаузиуса.
- •Связь скорости теплового движения молекул с температурой. Уравнение Больцмана.
- •Распределение молекул по скоростям их движения (распределение Максвелла).
- •Барометрическая формула. Газ в потенциальном поле. Распределение Больцмана.
- •Уравнение состояния идеального газа. Термодинамическое равновесие. Среднестатистические значения параметров состояния. Флуктуации.
- •Первый закон термодинамики. Внутренняя энергия идеального газа. Работа газа в изопроцессах.
- •Изохорный процесс. Теплоемкость Cv. Изобарный процесс. Теплоемкость Ср.
- •Адиабатный процесс. Уравнение Пуассона.
- •Энтропия идеального газа. Основное уравнение термодинамики.
- •Изотермы реального газа (изотермы Ван-дер-Ваальса и Эндрюса). Метастабильные состояния.
- •Критические параметры состояния и поправки Ван-дер-Ваальса. Уравнение соответственных состояний.
- •Внутренняя энергия реального газа. Расширение газа в вакуум.
- •39. Эффект Джоуля-Томсона. Энтальпия. Температура инверсии. Сжижение газов.
- •40. )Фазовые переходы первого рода. Уравнение Клаузиуса-Клапейрона. Диаграмма состояния вещества.
- •Явления переноса. Средняя длина свободного пробега молекул.
- •Циклические процессы. Обратимые и необратимые процессы. К.П.Д. Тепловой машины. Цикл Карно.
- •Второй закон термодинамики.
- •Неравенство Клаузиуса. Энтропия.
Основное уравнение мкт в форме Клаузиуса.
P,V,T – параметры состояний, характеризующие термодинамическую систему.
Уравнение
Менделеева - Клаперона:
 ,
феноменологическое уравнение
,
феноменологическое уравнение
Это уравнение описывает равновесное состояние термодинамической системы.
Равновесное состояние – такое состояние, при котором все параметры системы остаются постоянными
Принцип локального равновесия – позволяет рассчитывать локальные состояния по уравнению равновесного состояния
Вывод уравнения:
Будем считать, что взаимодействия со стенкой упругое и применим для описания этого взаимодействия закон Ньютона.


 =>
=>
 ν – частота
соударений
ν – частота
соударений
 =>
=>

 =>
=>
 =>
=>
 – основное уравнение МКТ в форме
Клаузиуса.
– основное уравнение МКТ в форме
Клаузиуса.
Связывает V и P c энергией движения молекул
Связь скорости теплового движения молекул с температурой. Уравнение Больцмана.
Распределение энергии по степеням свободы молекул. Понятие температуры в МКТ.
 ,
где <ε>
- среднее значение кинетической энергии
молекулы
,
где <ε>
- среднее значение кинетической энергии
молекулы
k – постоянная Больцмана


Уравнение Больцмана:
Запишем
уравнение
 .
Это формула определяет только энергию
поступательного движения.
.
Это формула определяет только энергию
поступательного движения.
Но наряду с поступательным движением возможны также вращение молекул и колебания атомов в молекуле.
Т.к. оба эти движения тоже связаны с некоторым запасом энергии, определить общую энергию позволяет положение о равнораспределении энергии по степеням свободы молекулы.
Числом степеней свободы механической системы называют количество независимых величии, с помощью которых может быть задано положение системы. Степени свободы бывают поступательные, вращательные, колебательные). Рассматривает атомы как материальные точки, молекулы с жесткой связью атомов.
Например, для одноатомной молекулы, число степеней свободы(i) равно 3.
Для двухатомной молекулы – 5(3 поступательных, 2 вращательных(2 оси вращения, третья бессмысленна))
Для многоатомной молекулы – 6(3 поступательных, 3 вращательных(3оси вращения))
Для
любой молекулы обязательны 3 поступательных
степени свободы. Т.к. ни одна из них не
имеет преимущества перед остальными,
на каждую из них приходится по формуле
энергия равная
 .
.
В классической статической физике выводится закон равнораспределения, согласно которому на каждую степень свободы приходится в среднем одинаковая кинетическая энергия равная .
Таким
образом, средняя энергия молекулы должны
равняться:
 .(Уравнение
МКТ в форме Больцмана).
.(Уравнение
МКТ в форме Больцмана).
Понятие температуры в МКТ
К определению понятия температуры можно прийти на основании следующих соображений. Если соприкасающиеся тела находятся в состоянии теплового равновесия, т.е. не обмениваются энергией путем теплопередачи, то этим телам приписывается одинаковая температура.
Если при установлении теплового контакта между телами одно из них передает энергию другому посредством теплопередачи, то первому приписывается большая температура, чем второму.
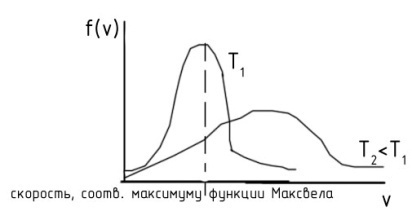
Распределение молекул по скоростям их движения (распределение Максвелла).
Максвелл предположил, что скорость частиц газа подчиняется закону Гаусса.

Из условий:
- компоненты скорости независимы
- подчиняются закону Гаусса
- вероятности умножаются
выведем: