
- •« Кислоты»
- •« Соли»
- •« Кислые соли»
- •« Основные соли»
- •Какие оксиды называются несолеобразующими? Приведите примеры.
- •Какие оксиды называются солеобразующими? Приведите примеры
- •Какие оксиды металлов растворимы в воде? Приведите примеры
- •Гидроксиды каких металлов растворимы в воде? Приведите пример. Как их называют?
- •5. Окислительно-восстановительные реакции
- •5.7. Что является окислителем в разбавленной серной кислоте?
- •Понятия о химической термодинамике
Основные понятия химии
Химия – это наука о превращениях веществ. Она изучает состав и строение веществ, зависимость свойств веществ от их состава и строения, условия и пути превращения одних веществ в другие.
Дайте определение понятию атом
Атом - Наименьшая частица элемента, обладающая его химическими свойствами. Атом состоит из ядра и «облака» электронов вокруг него. Ядро состоит из положительно заряженных протонов и нейтральных нейтронов.
Дайте определение понятию молекула
Молекула – наименьшая частица вещества, обладающая его химическими свойствами.
Дайте определение понятию химический элемент
Химический элемент — это вид атомов с определённым положительным зарядом ядра. Все химические элементы указаны в Периодической системе элементов Д. И. Менделеева; каждому элементу отвечает свой порядковый (атомный) номер в Периодической системе. Значение порядкового номера элемента и значение заряда ядра атома того же элемента совпадают, то есть химический элемент — это совокупность атомов с одинаковым порядковым номером.
Абсолютная атомная масса – определение. Размерность.
Абсолютная атомная масса-это истинная масса эллемента. Выражается единицах измерения г,кг.
Она находится по следующей формуле:
mo=M/Na, нужно разделить молряную массу на постоянное Авогадро.
Дайте определение понятию моль.
Моль – количество вещества, содержащее столько молекул, атомов, ионов, электронов или других структурных единиц, сколько содержится атомов в 12г изотопа углерода С.
Дайте определение понятию молярная масса.
Молярная масса – отношение массы m вещества к его количеству n. М=m/n
Молярную массу обычно выражают в г/моль.
Что называется молярным объемом?
Молярный объем – отношение объема, занимаемого веществом, к его количеству. При нормальных условиях молярный объем любого газа равен 22,4 л/моль.
Дайте определение понятию относительная атомная масса. Какова размерность этой величины?
Относительная атомная масса элемента называют отношение массы его атома к 1/12 части массы атома С. В современной шкале относ.атомные массы кислорода и водорода равны соответственно 15,9994 и 1,00794. Размерность г/моль
Какие вещества называются простыми? Приведите примеры.
Простые вещества — вещества, состоящие исключительно из атомов одного химического элемента, в отличие от сложных веществ. Являются формой существования химических элементов в свободном виде; или, иначе говоря, элементы, не связанные химически ни с каким другим элементом, образуют простые вещества.
В зависимости от типа химической связи между атомами простые вещества могут быть металлами (Na, Mg, Al, Bi и др.) и неметаллами (H2, N2, Br2, Si и др.).
Примеры простых веществ: молекулярные (O2, O3, H2, Cl2) и атомарные (He, Ar) газы; различные формы углерода, иод (I2), металлы (не в виде сплавов).
Сложное вещество. Дайте определение, приведите примеры.
Сложные вещества, или химические соединения, -- это вещества, образованные атомами разных элементов.
Так, оксид меди (II) образован атомами элементов меди и кислорода, вода — атомами элементов водорода и кислорода.
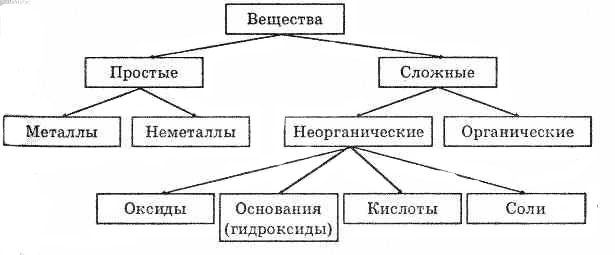
Классы неорганических соединений
Простые(металы,неметаллы), Сложные( оксиды, основания, кислоты, соли)
Дайте определение классу неорганических соединений «оксиды»
Оксиды - это сложные вещества, состоящие из двух элементов, один из которых кислород. В оксидах степень окисления атома кислорода —2. Например: СО-оксид углерода(||), Fe2O3-оксид железа (|||), MgO.
« Основания»
Основания (осно́вные гидрокси́ды) — сложные вещества, которые состоят из атомов металла или иона аммония и гидроксогруппы (-OH). В водном растворе диссоциируют с образованием катионов и анионов ОН−. Хорошо растворимые в воде основания называются щелочами.
Наиболее характерное химическое свойство оснований – их способность взаимодействовать с кислотами (а также с кислотными и амфотерными оксидами) с образованием солей, например: KOH+HCl=KCl+H2O, Ca(OH)2+CO2=CaCO3+H2O, 2NaOH+ZnO=Na2ZnO2+H2O
« Кислоты»
Кислота – это сложное вещество, в молекуле которого имеется один или несколько атомов водорода и кислотный остаток.
Наиболее характерное хим.свойство кислот – их способность реагировать с основаниями (а также с основными и амфотерными оксидами) с образованием солей, например: H2SO4+2NaOH=Na2SO4+2H2O, 2HNO3+FeO=Fe(NO3)2+H2O, 2HCl+ZnO=ZnCl2+H2O
Кислоты делятся по силе, по основности и по наличию или отсутствию кислорода в составе кислоты. По силе кислоты делятся на сильные и слабые. Важнейшие сильные азотная HNO3, серная H2SO4 и соляная HCl. По наличию кислорода различают кислородсодержащие(HNO3, H3PO4..)и безкислород.(HCl, H2S, HCN..). Одноосновные(HCl, HNO3),двухосновные(H2S, H2SO4), трехосновные(H3PO4)..
« Соли»
Соли - сложные вещества, которые состоят из атомов металла и кислотных остатков.
Примеры типичных солей приведены ниже. NaCl – хлорид натрия, Na2SO4 – сульфат натрия, СаSO4 – сульфат кальция, СаCl2 – хлорид кальция,
« Кислые соли»
Кислые соли, помимо ионов металла и кислотного остатка, содержат ионы водорода.
Кислые соли могут быть образованы только кислотами, основность которых равна двум или больше.
KO4+H2SO4=KHSO4+H20 KHSO4-гидросульфат калия-кислая соль
Названия кислых солей содержат приставку "гидро" (от слова hydrogenium – водород). Например: NaHCO3 – гидрокарбонат натрия, K2HPO4 – гидрофосфат калия, KH2PO4 – дигидрофосфат калия.
« Основные соли»
При неполном замещении гидроксогрупп основания получаются основные соли. Могут быть образованы гидроксидами, содержащими не менее двух гидроксогрупп.
Mg(OH)Cl - хлорид гидроскомагния – основная соль
Какие оксиды называются несолеобразующими? Приведите примеры.
Несолеобразующие оксиды не способны взаимодействовать с кислотами или основаниями с образованием солей. К ним относятся N2O, NO, СО и некоторые другие оксиды.
Какие оксиды называются солеобразующими? Приведите примеры
Основными называются оксиды, взаимодействующие с кислотами(или с кислотными оксидами) с образованием солей. Присоединяя( непосредственно или косвенно) воду, основные оксиды образуют основания. Например, оксид кальция СаО реагирует с водой, образуя гидроксид кальция Са(ОН)2: СаО+Н2О=Са(ОН)2. Оксид магния MgO – тоже основной оксид. Он малорастворим в воде, но ему соответствует основание – гидроксид магния Mg(OH)2, кот-ый можно получить из MgO косвенным путем. Еще в пример Na2O; CuO
Амфотерными наз-ся оксиды, образующие соли при взаимодействии как с кислотами, так и с основаниями. К таким оксидам относятся, например,
ZnO; Al2O3; Cr2O3; SnO2, PbO2
Кислотными наз-ся оксиды, взаимодействующие с основаниями( или с основными оксидами) с образованием солей. Присоединяя (непосредственно или косвенно) воду, кислотные оксиды образуют кислоты. Так, триоксид серы SO3 взаимодействует с водой, образуя серную кислоту H2SO4: SO3+H2O = H2SO4/////// еще примеры SO2; SO3; P2O5; Mn2O7; CrO3
Какие оксиды металлов растворимы в воде? Приведите примеры
ВаО-оксид бария, К2О-оксид калия
