
- •Законы стехиометрии
- •Субатомные частицы
- •Электроны в атоме
- •7. Изменения химических свойств элементов и их соединений в группах:
- •Меняется размер атома
- •Изменения химических свойств элементов и их соединений в периодах:
- •Гомогенный катализ
- •Гетерогенный катализ
- •Аллотропные модификации углерода Кристаллический углерод
- •[Править]Аморфный углерод
- •В электротехнике
Гомогенный катализ
Примером гомогенного катализа является разложение пероксида водорода в присутствии ионов йода. Реакция протекает в две стадии:
H2О2 + I → H2О + IO
H2О2 + IO → H2О + О2 + I
При гомогенном катализе действие катализатора связано с тем, что он вступает во взаимодействие с реагирующими веществами с образованием промежуточных соединений, это приводит к снижению энергии активации.
Гетерогенный катализ
При гетерогенном катализе ускорение процесса обычно происходит на поверхности твердого тела — катализатора, поэтому активность катализатора зависит от величины и свойств его поверхности. На практике катализатор обычно наносят на твердый пористый носитель.
Механизм гетерогенного катализа сложнее, чем у гомогенного. Механизм гетерогенного катализа включает пять стадий, причем все они обратимы.
Диффузия реагирующих веществ к поверхности твердого вещества
Физическая адсорбция на активных центрах поверхности твердого вещества реагирующих молекул и затем хемосорбция их
Химическая реакция между реагирующими молекулами
Десорбция продуктов с поверхности катализатора
Диффузия продукта с поверхности катализатора в общий поток
Примером гетерогенного катализа является окисление SO2 в SO3 на катализаторе V2O5 при производстве серной кислоты(контактный метод).
19. Ферменты присутствуют во всех живых клетках и способствуют превращению одних веществ (субстратов) в другие (продукты). Ферменты выступают в роли катализаторов практически во всех биохимических реакциях, протекающих в живых организмах — ими катализируется более 4000 разных биохимических реакций[2]. Ферменты играют важнейшую роль во всех процессах жизнедеятельности, направляя и регулируя обмен веществ организма.
Подобно всем катализаторам, ферменты ускоряют как прямую, так и обратную реакцию, понижая энергию активации процесса.Химическое равновесие при этом не смещается ни в прямую, ни в обратную сторону. Отличительной особенностью ферментов по сравнению с небелковыми катализаторами является их высокая специфичность — константа связывания некоторых субстратов с белком может достигать 10−10 моль/л и менее. Каждая молекула фермента способна выполнять от нескольких тысяч до нескольких миллионов «операций» в секунду.
Например, одна молекула фермента ренина, содержащегося в слизистой оболочке желудка телёнка, створаживает около 106молекул казеиногена молока за 10 мин при температуре 37 °C.
При этом эффективность ферментов значительно выше эффективности небелковых катализаторов — ферменты ускоряют реакцию в миллионы и миллиарды раз, небелковые катализаторы — в сотни и тысячи раз. См. также Каталитически совершенный фермент
Ферменты обычно проявляют высокую специфичность по отношению к своим субстратам (субстратная специфичность). Это достигается частичной комплементарностью формы, распределения зарядов и гидрофобных областей на молекуле субстрата и в центре связывания субстрата на ферменте. Ферменты обычно демонстрируют также высокий уровень стереоспецифичности (образуют в качестве продукта только один из возможных стереоизомеров или используют в качестве субстрата только один стереоизомер), региоселективности (образуют или разрывают химическую связь только в одном из возможных положений субстрата) и хемоселективности (катализируют только одну химическую реакцию из нескольких возможных для данных условий). Несмотря на общий высокий уровень специфичности, степень субстратной и реакционной специфичности ферментов может быть различной. Например, эндопептидаза трипсин разрывает пептидную связь только после аргинина или лизина, если за ними не следует пролин, а пепсин гораздо менее специфичен и может разрывать пептидную связь, следующую за многими аминокислотами.
20. Обратимые реакции — химические реакции, протекающие одновременно в двух противоположных направлениях (прямом и обратном), например:
3H2 + N2 ⇌ 2NH3.
Направление обратимых реакций зависит от концентраций веществ — участников реакции. Так в приведённой реакции, при малой концентрации аммиака в газовой смеси и больших концентрациях азота и водорода происходит образование аммиака; напротив, при большой концентрации аммиака он разлагается, реакция идёт в обратном направлении. По завершении обратимой реакции, т. е. при достижении химического равновесия, система содержит как исходные вещества, так и продукты реакции.
Простая (одностадийная) обратимая реакция состоит из двух происходящих одновременно элементарных реакций, которые отличаются одна от другой лишь направлением химического превращения. Направление доступной непосредственному наблюдению итоговой реакции определяется тем, какая из этих взаимно-обратных реакций имеет большую скорость. Например, простая реакция
N2O4 ⇌ 2NO2
складывается из элементарных реакций
N2O4 ⇌ 2NO2 и 2NO2 ⇌ N2O4.
Для обратимости сложной (многостадийной) реакции, например уже упоминавшейся реакции синтеза аммиака, необходимо, чтобы были обратимы все составляющие её стадии.
Необратимые реакции — реакции, при которых взятые вещества нацело превращаются в продукты реакции, не реагирующие между собой при данных условиях, например, разложение взрывчатых веществ, горение углеводородов, образованиемалодиссоциирующих соединений, выпадение осадка, образование газообразных веществ.
Ba(ClO2)2 + H2SO4 → 2HClO2 + BaSO4↓
NaHCO3 + CH3COOH → CH3COONa + H2O + CO2↑
Однако надо понимать, что при изменении условий протекания реакции, теоретически возможно сместить равновесие любой реакции.
Химическое равновесие — состояние химической системы, в котором обратимо протекает одна или несколько химических реакций, причём скорости в каждой паре прямая-обратная реакция равны между собой. Для системы, находящейся в химическом равновесии, концентрации реагентов, температура и другие параметры системы не изменяются со временем.[1]
А2 + В2 ⇄ 2AB
21. Окисли́тельно-восстанови́тельные реа́кции, ОВР, редокс (от англ. redox ← reduction-oxidation — окисление-восстановление) — это встречно-параллельные химические реакции, протекающие с изменением степеней окисления атомов, входящих в состав реагирующих веществ, реализующихся путём перераспределения электронов между атомом-окислителем и атомом-восстановителем. Межмолекулярные — реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах разных веществ, например:
Н2S + Cl2 → S + 2HCl
Внутримолекулярные — реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах одного и того же вещества, например:
2H2O → 2H2 + O2
Диспропорционирование (самоокисление-самовосстановление) — реакции, в которых один и тот же элемент выступает и как окислитель, и как восстановитель, например:
Cl2 + H2O → HClO + HCl
Репропорционирование (конпропорционирование) — реакции, в которых из двух различных степеней окисления одного и того же элемента получается одна степень окисления, например:
NH4NO3 → N2O + 2H2O
22. Окисли́тель — вещество, в состав которого входят атомы, присоединяющие во время химической реакции электроны, иными словами, окислитель — это акцептор электронов.
В зависимости от поставленной задачи (окисление в жидкой или в газообразной фазе, окисление на поверхности) в качестве окислителя могут быть использованы самые разные вещества.
O2 кислород O3 озон Пероксиды галогены ClO− гипохлориты
ClO3− хлораты HNO3 азотная кислота H2SO4, конц.серная кислота Шестивалентный хром MnO4−перманганаты Катионы металлов и H+
23.
Восстановители,
вещества, отдающие электроны в
окислит.-восстановит. р-циях. Относит.
восстановит. способность двух и более
веществ определяется путем сравнения
изменений энергии
Гиббса ![]() при
реакциях этих веществ с одним и тем
же окислителем,
а в случае реакций с участием простых
веществ - энергией
Гиббса образования
при
реакциях этих веществ с одним и тем
же окислителем,
а в случае реакций с участием простых
веществ - энергией
Гиббса образования ![]() продуктов окисления простого
вещества (оксидов, галогенидов и т.п.)
В. применяют: для восстановления Fe
из руд (С,
Н2,
водяной и прир. газы,
СО, пропан,
бутан); при получении цветных и
редких металлов в
процессах металлотермии (С,
Si, Al, Na, Ca, Mg, La); при выделении
(цементации) цветных
металлов из
водных растворов их солей (Fe,
Zn); при получении металлов,
их низших оксидов и
галогенидов и при
хим.осаждении металлов, нитридов и карбидов из
газовой фазы (Н2,
NH3,
CH4 и
др.); при проведении разл. хим. процессов
в растворах (SnCl2,
FeSO4,
H2SO3,
N2H4,
NH2OH,
HCOOH, H2S
и др.); в орг. синтезе (Н2,
Na, Zn, Li[AlH4],
Na[BH4],
B2H6 и
др.); как проявляющие вещества в фотографии
(гидрохинон, амидол, метол, фенидон и
др.). В хим. источниках тока В. (Li, Na, Zn,
некоторые др. металлы,
а также сплавы) входят в состав анодов.
К сильным В. принадлежат щелочные и
щел.-зем. металлы,
Al, Si, С, Н2 и
ряд др. простых веществ, гидриды металлов и
соед., содержащие неметаллы с
отрицат. степенями
окисления (
продуктов окисления простого
вещества (оксидов, галогенидов и т.п.)
В. применяют: для восстановления Fe
из руд (С,
Н2,
водяной и прир. газы,
СО, пропан,
бутан); при получении цветных и
редких металлов в
процессах металлотермии (С,
Si, Al, Na, Ca, Mg, La); при выделении
(цементации) цветных
металлов из
водных растворов их солей (Fe,
Zn); при получении металлов,
их низших оксидов и
галогенидов и при
хим.осаждении металлов, нитридов и карбидов из
газовой фазы (Н2,
NH3,
CH4 и
др.); при проведении разл. хим. процессов
в растворах (SnCl2,
FeSO4,
H2SO3,
N2H4,
NH2OH,
HCOOH, H2S
и др.); в орг. синтезе (Н2,
Na, Zn, Li[AlH4],
Na[BH4],
B2H6 и
др.); как проявляющие вещества в фотографии
(гидрохинон, амидол, метол, фенидон и
др.). В хим. источниках тока В. (Li, Na, Zn,
некоторые др. металлы,
а также сплавы) входят в состав анодов.
К сильным В. принадлежат щелочные и
щел.-зем. металлы,
Al, Si, С, Н2 и
ряд др. простых веществ, гидриды металлов и
соед., содержащие неметаллы с
отрицат. степенями
окисления ( ![]() и
др.). Очень сильной восстановит.
способностью обладают растворы,
содержащие своб. или сольватированные
электроны,
например аммиачные растворы щелочных
и щел.-зем. металлов (см.
Аммиак), а также атомарный водород.
и
др.). Очень сильной восстановит.
способностью обладают растворы,
содержащие своб. или сольватированные
электроны,
например аммиачные растворы щелочных
и щел.-зем. металлов (см.
Аммиак), а также атомарный водород.
Восстановление меди водородом из оксида меди (II) (практическая работа)
Водород – прекрасный восстановитель. Водород способен восстанавливать металлы из их оксидов. Пример ‑ восстановление меди. В пробирке – черный порошок оксида меди. Получаем водород взаимодействием цинка и соляной кислоты.
Zn + 2HCl = ZnCl2 + H2↑
Направим водород в пробирку. Реакция восстановления меди идет при нагревании:
CuO + H2 = Cu + H2O
Водород связывает кислород, образуя воду, выделяется свободная медь.
24. Окисли́тельно-восстанови́тельные реа́кции, ОВР, редокс (от англ. redox ← reduction-oxidation — окисление-восстановление) — это встречно-параллельные химические реакции, протекающие с изменением степеней окисления атомов, входящих в состав реагирующих веществ, реализующихся путём перераспределения электронов между атомом-окислителем и атомом-восстановителем.
Реакции, в результате которых изменяются степени окисления элементов, входящих в состав реагирующих веществ и продуктов реакции, называют окислительно-восстановительными реакциями.
Fe2O3 +
CO ![]() Fe
+ CO2.
Fe
+ CO2.
1. Определим степени окисления элементов:
![]()
2. Подчеркнем символы элементов, степени окисления которых изменяются:
![]()
3. Выпишем элементы, изменяющие степени окисления:
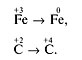
4. Составим электронные уравнения, определяя число отданных и принятых электронов:

. Число отданных и принятых электронов должно быть одинаково, т.к. не заряжены ни исходные вещества, ни продукты реакции. Уравниваем число отданных и принятых электронов, подобрав наименьшее общее кратное (НОК) и дополнительные множители:
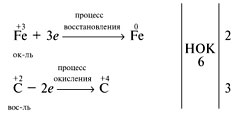
6. Полученные множители являются коэффициентами. Перенесем коэффициенты в схему реакции:
Fе2О3 + 3СО = 2Fе + 3СО2.
25. Окисли́тельно-восстанови́тельные реа́кции, ОВР, редокс (от англ. redox ← reduction-oxidation — окисление-восстановление) — это встречно-параллельные химические реакции, протекающие с изменением степеней окисления атомов, входящих в состав реагирующих веществ, реализующихся путём перераспределения электронов между атомом-окислителем и атомом-восстановителем.
Реакции, в результате которых изменяются степени окисления элементов, входящих в состав реагирующих веществ и продуктов реакции, называют окислительно-восстановительными реакциями.
26. Теории кислот и оснований — совокупность фундаментальных физико-химических представлений, описывающих природу и свойства кислот и оснований. Все они вводят определения кислот и оснований -- двух классов веществ, реагирующих между собой. Задача теории -- предсказание продуктов реакции между кислотой и основанием и возможности её протекания, для чего используются количественные характеристики силы кислоты и основания. Различия между теориями лежат в определениями кислот и оснований, характеристики их силы и, как следствие -- в правилах предсказания продуктов реакции между ними. Все они имеют свою область применимости, каковые области частично пересекаются.
Кислотно-основные взаимодействия чрезвычайно распространенены в природе и находят широкое применение в научной и производственной практике. Теоретические представления о кислотах и основаниях имеют важное значение в формировании всех концептуальных систем химии и оказывают разностороннее влияние на развитие многих теоретических концепций во всех основных химических дисциплинах.
На основе современной теории кислот и оснований разработаны такие разделы химических наук, как химия водных и неводных растворов электролитов, рН-метрия в неводных средах, гомо- и гетерогенный кислотно-основный катализ, теория функций кислотности и многие другие.
В теории Льюиса (1923 г.) на основе электронных представлений было ещё более расширено понятие кислоты и основания. Кислота Льюиса — молекула или ион, имеющие вакантные электронные орбитали, вследствие чего они способны принимать электронные пары. Это, например, ионы водорода – протоны, ионы металлов (Ag+, Fe3+), оксиды некоторых неметаллов (например, SO3, SiO2), ряд солей (AlCl3), а также такие вещества как BF3, Al2O3. Кислоты Льюиса, не содержащие ионов водорода, называются апротонными. Протонные кислоты рассматриваются как частный случай класса кислот. Основание Льюиса — это молекула или ион, способные быть донором электронных пар: все анионы, аммиак иамины, вода, спирты, галогены. Примеры химических реакций между кислотами и основаниями Льюиса:
AlCl3 + Cl− → AlCl4−
BF3 + F− → BF4−
PCl5 + Cl− → PCl6−.
Водородная теория
Определения. Кислота -- вещество, способное реагировать с металлом с выделением водорода. Понятие "основание" в этой теории отсутствует. Продукты реакции. При реакции кислоты с металлом образуется соль и водород. Примеры. Кислота -- HCl. Реакция 2HCl + Zn = ZnCl2 + H2↑ Критерии протекания реакции. С сильными кислотами реагируют металлы, стоящие в ряду активностей левее водорода. Чем слабее кислота, тем более активный металл нужен для реакции между ними. Количественные характеристики.Поскольку теория используется редко, количественные характеристики силы кислоты (а значит, и предсказания направления реакции) в рамках данной теории не разработаны. Область применимости. Предсказание взаимодействия водородсодержащих веществ с металлами в любых растворителях. Специфические черты. В соответствии с этой теорией этиловый спирт и аммиак являются слабыми кислотами, так как способны реагировать со щелочными металлами:
2C2H5OH + 2Na = 2C2H5ONa + H2↑
2NH3 + 2Na = 2NaNH2 + H2↑
27. Истинные растворы. Такие растворы характеризуются полной гомогенностью благодаря одинаковым размерам частиц растворенного вещества и растворителя и отсутствию поверхностей раздела между ними. Истинные растворы — это однофазные дисперсные системы. Истинные растворы характеризуются большой прочностью связи между растворенной жидкостью и растворителем. Растворенная жидкость (вещество) в дальнейшем не отделяется от растворителя, остается равномерно распределенной в растворителе. Истинный раствор сохраняет гомогенность неопределенно долгое время, если только в нем не происходит никаких самопроизвольных вторичных процессов (например, гидролиза, окисления, фотосинтеза). Истинные растворы бывают ионно-дисперсными и молекулярно-дисперсными. Размер частиц в первых составляет менее 1 нм, а растворенное вещество находится в виде отдельных гидратированных ионов и молекул в равновесных количествах. Истинные растворы всегда прозрачны, они не должны содержать взвешенных частиц и осадка. Особенностью истинных растворов является то, что они гомогенны даже при рассматривании в электронный микроскоп. Компоненты, входящие в их состав, не могут быть разделены никаким способом. Истинные растворы хорошо диффундируют. К этой группе относятся растворы электролитов и неэлектролитов, таких как глюкоза, натрия хлорид, спирт, магния сульфат и т.д.
Истинные растворы высокомолекулярных соединений являются молекулярно-дисперсными системами, которые образованы дифильными макромолекулами. С одной стороны, они являются однофазными гомогенными системами (как и истинные растворы), а с другой — имеют некоторые особенности, сближающие их с коллоидными растворами (движение молекул, подобное броуновскому, малые скорости диффузии, неспособность к диализу, повышенная способность к образованию молекулярных комплексов и некоторые другие).
Растворение веществ сопровождается тепловым эффектом: выделением или поглощением теплоты - в зависимости от природы вещества. При растворении в воде, например, гидроксида калия, серной кислоты наблюдается сильное разогревание раствора, т.е. выделение теплоты, а при растворении нитрата аммония - сильное охлаждение раствора, т.е. поглощение теплоты. В первом случае осуществляется экзотермический процесс (∆H < 0), во втором - эндотермический (∆H > 0). Теплота растворения ∆H - это количество теплоты, выделяющееся или поглощающееся при растворении 1 моль вещества. Так, для гидроксида калия ∆H ° = -55,65 кДж/моль, а для нитрата аммония ∆H ° = +26,48 кДж/моль.
В результате химического взаимодействия растворенного вещества с растворителем образуются соединения, которые называют сольватами (или гидратами, если растворителем является вода). Образование таких соединений роднит растворы с химическими соединениями.
Особенно склонны к гидратации (соединению с водой) ионы. Ионы присоединяют полярные молекулы воды, в результате образуются гидратированные ионы; поэтому, например, в растворе ион меди (II) голубой, в безводном сульфате меди он бесцветный. Многие из таких соединений непрочны и легко разлагаются при выделении их в свободном виде, однако в ряде случаев образуются прочные соединения, которые можно легко выделить из раствора кристаллизацией. При этом выпадают кристаллы, содержащие молекулы воды.
Таким образом, растворение - не только физический, но и химический процесс. Растворы образуются путем взаимодействия частиц растворенного вещества с частицами растворителя. Ученик Д.И. Менделеева Д.П. Коновалов всегда подчеркивал, что между химическими соединениями и растворами нет границ.
28. Раство́р — гомогенная (однородная) смесь, состоящая из частиц растворённого вещества, растворителя и продуктов их взаимодействия. "Гомогенный" - значит, каждый из компонентов распределён в массе другого в виде своих частиц, то есть атомов, молекул или ионов.[1].
Раствор — однофазная система переменного, или гетерогенного, состава, состоящая из двух или более компонентов.
Растворитель — компонент, агрегатное состояние которого не изменяется при образовании раствора. В случае же растворов, образующихся при смешении газа с газом, жидкости с жидкостью, твёрдого вещества с твёрдым, растворителем считается компонент, количество которого в растворе преобладает
Насыщенный раствор содержит максимальное количество ве-* щества, которое может растворяться в данном количестве растворителя при определенных условиях. Насыщенный раствор'^ находится в равновесии с избытком растворяемого вещества.} При этом данное равновесие является динамическим: в единицу времени столько частиц выпадает в осадок, сколько их переходит в раствор.
Концентрация насыщенного раствора того или иного вещества' при неизменных условиях есть величина постоянная. Если в насыщенный раствор внести какое-то новое количество растворяв емого вещества, то ровно столько, сколько внесли, выпадает в осадок. Концентрация насыщенного раствора является мерой растворимости вещества при данных условиях. Очень часто* растворимость выражают числом граммов растворенного вещества, которое содержится в 100 г раствора или же в 100 г растворителя. Для насыщенного раствора при постоянной температуре /ир=const, /ир. в=макс (тр—масса раствора, трв—масса растворенного вещества).
Ненасыщенный раствор — раствор, в котором концентрация растворенного вещества меньше, чем в насыщенном растворе, и в котором при данных условиях можно растворить еще некоторое его количество.
Перенасыщенный раствор
раствор, в котором при заданной температуре и давлении концентрация растворенного вещества больше, чем в насыщенном растворе. Неустойчивая однофазовая система: внесение кристалла растворенного вещества или встряхивание вызывает кристаллизацию.
Массовая доля — отношение массы растворённого вещества к массе раствора. Массовая доля измеряется в долях единицы или в процентах.
![]() ,
,
где:
m1 — масса растворённого вещества, г ;
m — общая масса раствора, г .
Массовое процентное содержание компонента, m%
m%=(mi/Σmi)*100
Объёмная доля — отношение объёма растворённого вещества к объёму раствора. Объёмная доля измеряется в долях единицы или в процентах.
![]() ,
,
где:
V1 — объём растворённого вещества, л;
V — общий объём раствора, л.
Молярная
концентрация — количество растворённого
вещества (число молей) в единице объёма
раствора. Молярная концентрация в системе
СИ измеряется
в моль/м³, однако на практике её гораздо
чаще выражают в моль/л или ммоль/л. Также
распространено выражение в «молярности».
Возможно другое обозначение молярной
концентрации ![]() ,
которое принято обозначать М. Так,
раствор с концентрацией 0,5 моль/л называют
0,5-молярным. Примечание: единица «моль»
не склоняется по падежам. После цифры
пишут «моль», подобно тому, как после
цифры пишут «см», «кг» ттт и т. д.
,
которое принято обозначать М. Так,
раствор с концентрацией 0,5 моль/л называют
0,5-молярным. Примечание: единица «моль»
не склоняется по падежам. После цифры
пишут «моль», подобно тому, как после
цифры пишут «см», «кг» ттт и т. д.
![]() ,
,
где:
ν — количество растворённого вещества, моль;
V — общий объём раствора, л.
Моляльность — количество растворённого вещества (число моль) в 1000 г растворителя. Измеряется в молях на кг, также распространено выражение в «моляльности». Так, раствор с концентрацией 0,5 моль/кг называют 0,5-мольным.
![]() ,
,
где:
ν — количество растворённого вещества, моль;
m2 — масса растворителя, кг.
Титр раствора — масса растворённого вещества в 1 мл раствора.
![]() ,
,
где:
m1 — масса растворённого вещества, г;
V — общий объём раствора, мл;
Существуют и другие, распространённые в определённых областях знаний или технологиях, методы выражения концентрации. Например, в фотометрии часто используют массовую концентрацию, равную массе растворённого вещества в 1 л раствора. При приготовлении растворов кислот часто указывают, сколько объёмных частей воды приходится на одну объёмную часть концентрированной кислоты (например, 1:3). Концентрация загрязнений в воздухе может выражаться в частях на миллион (ppm). Иногда используют также отношение масс (отношение массы растворённого вещества к массе растворителя) и отношение объёмов (аналогично, отношение объёма растворяемого вещества к объёму растворителя).
29. Электролиты — вещества, проводящие в расплавах или водных растворах электрический ток. В расплавах или водных растворах они диссоциируют на ионы. Неэлектролиты — вещества, водные растворы и расплавы которых не проводят электрический ток, так как их молекулы не диссоциируют на ионы. Электролиты при растворении в подходящих растворителях (вода, другие полярные растворители) диссоциируют на ионы. Сильное физико-химическое взаимодействие при растворении приводит к сильному изменению свойств раствора (химическая теория растворов).
Вещества, которые в тех же условиях на ионы не распадаются и электрический ток не проводят, называются неэлектролитами.
К электролитам относятся кислоты, основания и почти все соли, к неэлектролитам — большинство органических соединений, а также вещества, в молекулах которых имеются только ковалентные неполярные или малополярные связи.
Исходя из степени диссоциации все электролиты делятся на две группы
Сильные электролиты — электролиты, степень диссоциации которых в растворах равна единице (то есть диссоциируют полностью) и не зависит от концентрации раствора. Сюда относятся подавляющее большинство солей, щелочей, а также некоторые кислоты (сильные кислоты, такие как: HCl, HBr, HI, HNO3).
Слабые электролиты — степень диссоциации меньше единицы (то есть диссоциируют не полностью) и уменьшается с ростом концентрации. К ним относят воду, ряд кислот (слабые кислоты), основания p-, d-, и f- элементов.
Между этими двумя группами четкой границы нет, одно и то же вещество может в одном растворителе проявлять свойства сильного электролита, а в другом — слабого.
30. Электролитическая диссоциация — процесс распада электролита на ионы при его растворении или плавлении.
 Степень
диссоциации —
величина, характеризующая
состояние равновесия в реакции диссоциации в гомогенных
(однородных) системах.
Степень
диссоциации —
величина, характеризующая
состояние равновесия в реакции диссоциации в гомогенных
(однородных) системах.
"Степень диссоциации это есть отношения числа продиссоциируемых молекул к общему числу молекул и умноженному на 100%":
![]()
числа распавшихся на ионы молекул к общему числу растворенных молекул
31. Ио́нное произведе́ние воды́ — произведение концентраций ионов водорода Н+ и ионов гидроксила OH− в воде или в водныхрастворах, константа автопротолиза воды. Вода, хотя и является слабым электролитом, в небольшой степени диссоциирует:
![]()
Равновесие этой реакции сильно смещено влево. Константу диссоциации воды можно вычислить по формуле:
![]()
где:
[H+] — концентрация ионов гидроксония (протонов);
[OH−] — концентрация гидроксид-ионов;
[H2O] — концентрация воды (в молекулярной форме) в воде;
Концентрация воды в воде, учитывая её малую степень диссоциации, величина практически постоянная и составляет (1000 г/л)/(18 г/моль) = 55,56 моль/л.
При 25 °C константа диссоциации воды равна 1,8·10−16моль/л. Уравнение (1) можно переписать как:
![]()
Обозначим произведение K·[H2O] = Kв = 1,8·10−16 моль/л·55,56 моль/л = 10−14моль²/л² = [H+]·[OH−] (при 25 °C).
Константа Kв, равная произведению концентраций протонов и гидроксид-ионов, называется ионным произведением воды. Она является постоянной не только для чистой воды, но также и для разбавленных водных растворов веществ. C повышением температуры диссоциация воды увеличивается, следовательно, растёт и Kв, при понижении температуры — наоборот.
Водоро́дный показа́тель, pH (произносится «пэ аш», английское произношение англ. pH — piː'eɪtʃ, «пи эйч») — мераактивности (в очень разбавленных растворах она эквивалентна концентрации) ионов водорода в растворе, и количественно выражающая его кислотность, вычисляется как отрицательный (взятый с обратным знаком) десятичный логарифм активностиводородных ионов, выраженной в молях на литр:
![]()
В чистой воде при 25 °C концентрации ионов водорода ([H+]) и гидроксид-ионов ([OH−]) одинаковы и составляют 10−7 моль/л, это напрямую следует из определения ионного произведения воды, которое равно [H+] · [OH−] и составляет 10−14 моль²/л² (при 25 °C).
Когда концентрации обоих видов ионов в растворе одинаковы, говорят, что раствор имеет нейтральную реакцию. При добавлении к воде кислоты концентрация ионов водорода увеличивается, а концентрация гидроксид-ионов соответственно уменьшается, при добавлении основания — наоборот, повышается содержание гидроксид-ионов, а концентрация ионов водорода падает. Когда [H+] > [OH−] говорят, что раствор является кислым, а при [OH−] > [H+] — щелочным.
Для удобства представления, чтобы избавиться от отрицательного показателя степени, вместо концентраций ионов водорода пользуются их десятичным логарифмом, взятым с обратным знаком, который собственно и является водородным показателем — pH.
32. Вода реагирует при комнатной температуре:
с активными металлами (натрий, калий, кальций, барий и др.)
![]()
с фтором и межгалоидными соединениями
![]()
![]() при
низких температурах
при
низких температурах
![]()
![]()
с солями, образованными слабой кислотой и слабым основанием, вызывая их полный гидролиз
![]()
Вода реагирует при нагревании:
с железом, магнием
![]()
с углем, метаном
![]()
Вода реагирует в присутствии катализатора:
с амидами, эфирами карбоновых кислот
с ацетиленом и другими алкинами
с алкенами
с нитрилами
По состоянию различают:
Твёрдое — лёд
Жидкое — вода
Газообразное — водяной пар
При нормальном атмосферном давлении (760 мм рт. ст., 101 325Па) вода переходит в твердое состояние при температуре в 0 °C и кипит (превращается в водяной пар) при температуре 100 °C (температура 0 °C и 100 °C были специально выбраны как температура таяния льда и кипения воды при создании температурной шкалы «по Цельсию» в системе СИ). ри температуре 374 °C (647 K) и давлении 22,064 МПа (218 атм) вода проходит критическую точку. В этой точке плотность и другие свойства жидкой и газообразной воды совпадают. При более высоком давлении нет разницы между жидкой водой и водяным паром, следовательно, нет и кипения или испарения.
Молекула воды имеет угловую форму: атомы водорода по отношению к кислороду образуют угол, равный приблизительно 108° Из-за большой разности электроотрицательностей атомов водорода и кислорода электроны всех атомов, составляющих молекулу воды, сильно смещены в сторону кислорода. Вследствие этого атом кислорода приобретает частичный отрицательный заряд. Поэтому молекула воды — диполь: та часть молекулы, где находится водород, заряжена положительно, а часть, где находится кислород, — отрицательно.
Физические и химические свойства воды во многом обусловлены наличием водородных связей между молекулами воды — диполями.
33. Гидро́лиз (от др.-греч. ὕδωρ — вода и λύσις — разложение) — один из видов химических реакций сольволиза, где при взаимодействии веществ с водой происходит разложение исходного вещества с образованием новых соединений. Механизм гидролиза соединений различных классов: соли, углеводы, белки, сложные эфиры, жиры и др. имеет существенные различия. Гидролиз солей — разновидность реакций гидролиза, обусловленного протеканием реакций ионного обмена в растворах (преимущественно, водных) растворимых солей-электролитов. Движущей силой процесса является взаимодействие ионов с водой, приводящее к образованию слабого электролита в ионном или (реже) молекулярном виде («связывание ионов»).
Различают обратимый и необратимый гидролиз солей[1]:
1. Гидролиз соли слабой кислоты и сильного основания (гидролиз по аниону):
![]()
![]()
(раствор имеет слабощелочную среду, реакция протекает обратимо, гидролиз по второй ступени протекает в ничтожной степени)
2. Гидролиз соли сильной кислоты и слабого основания (гидролиз по катиону):
![]()
![]()
(раствор имеет слабокислую среду, реакция протекает обратимо, гидролиз по второй ступени протекает в ничтожной степени)
3. Гидролиз соли слабой кислоты и слабого основания:
![]()
(равновесие смещено в сторону продуктов, гидролиз протекает практически полностью, так как оба продукта реакции уходят из зоны реакции в виде осадка или газа).
Соль сильной кислоты и сильного основания не подвергается гидролизу, и раствор нейтрален. См. также Электролитическая диссоциация.
Гидролиз солей Взаимодействие ионов соли с водой, приводящее к образованию молекул слабого электролита, называют гидролизом солей. Различают несколько вариантов гидролиза солей: 1. Гидролиз соли слабой кислоты и сильного основания: Na2CO3 + Н2О = NaHCO3 + NaOH CO32- + H2O = HCO3- + OН- (раствор имеет щелочную реакцию, реакция протекает обратимо) 2. Гидролиз соли сильной кислоты и слабого основания: СuСl2 + Н2О = CuOHCl + HCl Cu2+ + Н2О = CuOH+ + Н+ (раствор имеет кислую реакцию, реакция протекает обратимо) 3. Гидролиз соли слабой кислоты и слабого основания: Al2S3 + 6H2O = 2Al(OН)3 + 3H2S 2Аl3+ + 3S2- + 6Н2О = 2Аl(OН)3 + ЗН2S (Гидролиз в этом случае протекает практически полностью, так как оба продукта гидролиза уходят из сферы реакции в виде осадка или газа). Соль сильной кислоты и сильного основания не подвергается гидролизу, и раствор нейтрален. Гидролиз жиров При гидролизе жиров в присутствии щелочей получают мыла; гидролиз жиров в присутствии катализаторов применяется для получения глицерина и жирных кислот.
34. Комплексные соединения (лат. complexus — сочетание, обхват) иликоординационные соединения (лат. co — «вместе» и ordinatio — «упорядочение») — частицы (нейтральные молекулы или ионы), которые образуются в результате присоединения к данному иону (или атому), называемомукомплексообразователем, нейтральных молекул или других ионов, называемыхлигандами. Теория комплексных соединений (координационная теория) была предложена в 1893 г. А. Вернером.
Комплексные соединения мало диссоциируют в растворе (в отличие от двойных солей). Комплексные соединения могут содержать комплексный малодиссоциирующий анион([Fe(CN)6]3−), комплексный катион ([Ag(NH3)2]+), либо вообще не диссоциировать на ионы (соединения типа неэлектролитов, например карбонилы металлов). Комплексные соединения разнообразны и многочисленны.
Лиганды — атомы или изолированные группы атомов, располагающиеся вокруг комплексообразователя. Лигандами могут быть частицы, до образования комплексного соединения представлявшие собой молекулы (H2O, CO, NH3 и др.), анионы (OH−, Cl−, PO43− и др.), а также катион водорода H+.
35. Устойчивость комплексных соединений может зависеть от величины рН раствора. Устойчивость комплексных соединений с органич. Устойчивость комплексных соединений зависит от заряда и значения 2 / г центрального атома. При увеличении г / г, или г2 / /, уменьшается рН осаждения гидроокисей металлов ( рис. XIII-2), растворимость сульфатов щелочноземельных элементов увеличивается. Устойчивость комплексного соединения зависит от дентатности лиганда, основности донорных атомов в нем, кислотно-основных свойств функциональной группы, участвующей в комплексообразо-вании, координационного числа центрального иона, числа образующихся циклов и их размеров, ионного радиуса центрального иона, молярного соотношения компонентов при взаимодействии и других факторов. Устойчивость комплексных соединений зависит от природы входящих в комплекс аддендов я реакции среды. Устойчивость комплексных соединений зависит от природы входящих в комплекс аддендов и комплексообразователя, а также от реакции среды. Устойчивость комплексного соединения зависит от дентатности лиганда, основности донорных атомов в нем, кислотно-основных свойств функциональной группы, участвующей в комплексообразо-вании, координационного числа центрального иона, числа образующихся циклов и их размеров, ионного радиуса центрального иона, молярного соотношения компонентов при взаимодействии и других факторов. Устойчивость комплексных соединений увеличивается, как правило, в том направлении, в котором происходит уменьшение ионного радиуса комплексо-образователя. Устойчивость комплексного соединения ( в твердом состоянии) определяется изменением свободной энергии при образовании его из аддендов и простой соли. [10]
Устойчивость комплексных соединений с ионом щелочного металла в качестве комплексообразователя понижается вниз по подгруппе элементов. [11]
36. s-блок в периодической таблице элементов — электронная оболочка, включающая в себя первые два слоя s-электронов.
Данный блок включает в себя щелочные металлы, щелочноземельные металлы, водород и гелий.
Эти элементы отличаются тем, что в атомном состоянии высокоэнергичныйэлектрон находится на s-орбитали. Исключая водород и гелий, эти электроны очень легко переходят и формируются в позитивные ионы при химической реакции.
Элементы IА и IIА подгрупп , у которых заполняется внешний ns-уровень, относятся к s-элементам: ns 1 – Li, Na, K, Rb, Cs, Fr называют щелочными , а ns 2 – Be, Mg, Ca, Sr, Ba, Ra –щелочноземельными . Из приведенных в таб. 8.1 данных следует:
Степени окисления элементов ns 1 и ns 2 всегда равны номеру группы (+1 и +2).
В основном состоянии атомы ns 2-элементов не имеют неспаренных электронов, поэтому образованию ковалентной связи в соединениях этих элементов предшествует возбуждение ns2 → ns 1np 1 с последующей гибридизацией sp-типа, определяющей линейное строение трехатомных молекул ЭX 2.
Для ns 1-элементов характерно образование двухатомных молекул Э 2(σ св) 2(σ *) 0; для ns 2-элементов образование Э 2 невозможно из-за равной заселенности связывающих и разрыхляющих σ-орбиталей.
Величины E °s-элементов предопределяют их восстановительные свойства, увеличиваясь при движении в подгруппе сверху вниз. Все s-элементы вытесняют водород из воды и кислот, восстанавливают оксиды металлов и неметаллов до простых веществ.
Ионность связи Э–Х возрастает в подгруппе сверху вниз, а в случае оснований удлинение связи Э–OH ведет к увеличению основности.
В соединениях LiX и BeX 2 связь Э–Х преимущественно ковалентная (малополярная).
Все щелочные металлы имеют один электрон в с-под оболочкой. В связи с наличием только одного электрона во внешней оболочке, они обладают высокой реакционной способностью, чтобы получить октет конфигурации. Благодаря наличию подобной электронной конфигурации, все элементы показывают сходство в их свойствах.
Физическое состояние: все элементы существуют в виде серебристо-белые, мягкие и легкие металлы. Они рассматриваются как металлы в связи с очень низкой энергией ионизации. Эти элементы являются податливым, т.е. могут быть сжаты в листах и также пластичных то есть они могут быть сделаны, чтобы провода. Они блестящие, когда свежесрезанных. Но, блеск тускнеет очень легко на воздухе.
Атомный радиус: как мы знаем, щелочные металлы являются крупнейшие элементы соответствующего периода.Атомная увеличения радиуса от лития до Франций, как мы движемся вниз периода.
Плотность: плотность возрастает при переходе от Li к Fr. Но, аномалия существует в случае натрия и калия K, где светлее, чем Na. Литий является самым легким металлом среди всех металлов. Li, Na и K легче по сравнению с водой.
Плавления и кипения: в связи с наличием большой атомный радиус, все эти элементы очень слабо связь во время формирования кристаллов. Из-за слабого межатомных связей, все эти элементы имеют очень низкую температуру плавления и кипения. Плавления и кипения уменьшается по мере продвижения вниз от Li к Cs.
39. Из-за высокой химической активности щелочные металлы встречаются на Земле исключительно в виде соединений, главным образом солей. Литий является редким элементом. Он входит в состав некоторых алюмосиликатов (в частности, сподумена
Li2O•Аl2О3•4SiO2), а также в форме хлорида LiСl присутствует в морской воде, подземных водах, водах соляных озёр. Рубидий и цезий встречаются в виде примесей к алюмосиликатам, содержащим калий.
Большинство солей щелочных металлов хорошо растворимы в воде; исключение составляют лишь соединения лития, а также соли некоторых кислот, например хлорной КСlО4. Интересно, что многие соли лития выделяются из растворов в виде кристаллогидратов, тогда как для солей тяжёлых щелочных металлов (например, цезия или даже калия) кристаллогидраты оказываются неустойчивыми. Это связано с последовательным увеличением ионного радиуса катиона при движении вниз по подгруппе. Чем больше радиус иона, тем ниже плотность заряда на его поверхности и тем сложнее иону удерживать молекулы воды. Вот почему соли калия менее гигроскопичны, чем аналогичные соли натрия. По этой причине в
пиротехнике и при производстве пороха предпочитают использовать калийную селитру, а не натриевую: она меньше отсыревает.
40. Соли щелочноземельных металлов, как и соли щелочных металлов, состоят из ионов. Соли этих металлов окрашивают пламя горелки в характерные цвета, для соединений Be и Me этого не наблюдается. Соли щелочноземельных металлов и ароматических кетилов [54] - это системы, в которых диполь-дипольное взаимодействие невелико. Щелочные соли алифатических кетилов [22] дают две димерные частицы, находящиеся в равновесии, из которых одна характеризуется интенсивным диполь-дипольным взаимодействием ( табл. 10), а другая - лишь незначительным диполь-дипольным взаимодействием Соли щелочноземельных металлов образуют аморфные осадки, щ мешающие обнаружению кристаллов оксихинолата магния. Соли щелочноземельных металлов обладают плотной консистенцией. В воде и спирте они не растворимы, растворяются в бензине и в более тяжелых ( керосиновых и масляных) дестиллатах, в особенности при повышенных температурах Соли щелочноземельных металлов получают взаимодействием оксидов или гидроксидов с кислотами. Фосфаты практически в воде нерастворимы. оли щелочноземельных металлов терефта-левой кислоты малорастворимы в воде Чтобы соли щелочноземельных металлов не отлагались в разлагателе на графитовых пластинках и не вызывали потерю их активности, вода, используемая для разложения, должна быть очищена от солей жесткости. Очистка воды необходима также в связи с требованиями, предъявляемыми к чистоте получаемой каустической соды. Обычно удовлетворяются катионитовой очисткой воды на сульфоугле; иногда для разложения амальгамы используют конденсат технического пара. Многие соли щелочноземельных металлов в отличие от солей щелочных металлов нерастворимы. Растворимые соли кальция и магния вызывают жесткость воды рисутствие солей щелочноземельных металлов затемняет картину образовавшегося осадка. От сернокислых солей этих металлов PbSO4 может быть отделен обработкой раствором едкой щелочи или уксуснокислого аммония ( см. также отделение щелочноземельных металлов и свинца
Метан может быть т & кже превращен в ацетилен путем частичного его сжигания в присутствии азота. Это может быть осуществлено путем пропускания над катализаторами, состоящими из солей щелочно-земельных металлов 7 а также путем действия электрических разрядов Набухание характеризует способность бентонитов поглощать воду и значительно увеличиваться в объеме, так как различные бентониты обладают неодинаковой набухаемостью. В водной среде наиболее высокой набухаемостью обладают щелочные бентониты. Они способны впитывать большое количество воды, увеличиваясь при этом в объеме в 15 - 20 раз. Щелочно-земельные бентониты набухают в воде слабо. Большое отрицательное влияние на набухаемость бентонитов оказывает наличие в воде солей, особенно солей щелочно-земельных металлов Эти соли ускоряют процесс насыщения поверхности деталей углеродом.
41. p-блок в периодической таблице элементов — электронная оболочка атомов, валентныеэлектроны которых с наивысшей энергией занимают p-орбиталь.
В p-блок входят последние шесть групп главной подгруппы, исключая гелий (который находится в s-блоке). Данный блок содержит все неметаллы (исключая водород и гелий) и полуметаллы, а также некоторые металлы.
P-блок содержит в себе элементы, которые имеют различные свойства, как физические, так и механические. P-неметаллы — это, как правило, высокореакционные вещества, имеющие сильную электроотрицательность, p-металлы — умеренно активные металлы, причём их активность повышается к низу таблицы химических элементов.
Общая характеристика четвертой группы главной подгруппы:
а) свойства элементов с точки зрения строения атома;
б) степени окисления;
в) свойства оксидов;
г) свойства гидроксидов;
д) водородные соединения.
а) Углерод (С), кремний (Si), германий (Ge), олово (Sn), свинец (РЬ) — элементы 4 группы главной подгруппы ПСЭ. На внешнем электронном слое атомы этих элементов имеют 4 электрона: ns2np2. В подгруппе с ростом порядкового номера элемента увеличивается атомный радиус, неметаллические свойства ослабевают, а металлические усиливаются: углерод и кремний - неметаллы, германий, олово, свинец — металлы.
б) Элементы этой подгруппы проявляют как положительную, так и отрицательную степени окисления: —4, +2, +4.
в) Высшие оксиды углерода и кремния (С02, Si02) обладают кислотными свойствами, оксиды остальных элементов подгруппы - амфотерны (Ge02, Sn02, Pb02).
г) Угольная и кремниевая кислоты (Н2СО3, H2SiO3) — слабые кислоты. Гидроксиды германия, олова и свинца амфотерны, проявляют слабые кислотные и основные свойства: H2GeO3= Ge(OH)4, H2SnO3 = Sn(ОН)4, Н2РЬО3 = Pb(OH)4.
д) Водородные соединения:
СН4; SiH4, GeH4. SnH4, PbH4. Метан — CH4 — прочное соединение, силан SiH4 - менее прочное соединение.
Схемы строения атомов углерода и кремния, общие и отличительные свойства.
С lS22S22p2;
Si 1S22S22P63S23p2.
Углерод и кремний - это неметаллы, так как на внешнем электронном слое 4 электрона. Но так как кремний имеет больший радиус атома, то для него более характерна способность отдавать электроны, чем для углерода. Углерод — восстановитель:
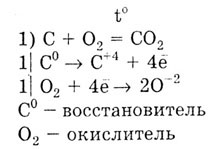
42. Углеро́д (химический символ — C) — химический элемент 4-ой группы главной подгруппы 2-го периода периодической системы Менделеева, порядковый номер 6, атомная масса — 12,0107 Углерод существует во множестве аллотропных модификаций с очень разнообразными физическими свойствами. Разнообразие модификаций обусловлено способностью углерода образовывать химические связи разного типа.
