
3.Закон разбавления Оствальда.
С изменением концентрации слабого электролита его степень диссоциации изменяется таким образом, что значение константы диссоциации остается постоянным.
Математически зависимость между степенью диссоциации, константой диссоциации и концентрацией раствора выражается законом разбавления Оствальда.
Пусть некоторая слабая кислота НА диссоциирует по схеме:
НАН+ + А-
НА - молярная концентрация (См) электролита в растворе.
Н+ = См ∙ - молярная концентрация ионов водорода.
Н+ = А- = См ∙
См ∙ (1-) - концентрация недиссоциированных молекул.
Н+А- См ∙ ∙ См∙ 2 ∙ См
Кд = НА = См(1-) = (1-)
При значениях 1 выражение упрощается:
Кдисс = 2 ∙ См
Из данного выражения видно, что при разбавлении раствора, т.е. при уменьшении его концентрации (См) степень диссоциации возрастает.
Закон Оствальда:
С увеличением разведения (уменьшением концентрации электролита) степень диссоциации электролита возрастает.
Зная характеристики и Кдисс можно рассчитать концентрацию ионов в растворах электролитов:
См иона = См эл-та∙ ∙ n
для сильного электролита = 1, поэтому
См иона = См эл-та∙ n
для слабого электролита = √ Кдисс/См, поэтому
См иона = √ См эл-та∙ Кдисс ∙ n,
где n – число ионов данного типа, образовавшихся при диссоциации одной молекулы электролита.
10.
Положения теории сильных электролитов
Согласно этой теории растворы электролитов представляют собой идеальные растворы. Однако применение её к описанию сильных электролитов наталкивается на ряд трудностей. Даже в разбавленных растворах сильные электролиты не ведут себя как идеальные растворы. Это обстоятельство заставило пересмотреть классическую теорию электролитической диссоциации применительно к сильным электролитам. Поэтому была разработана электростатическая теория сильных электролитов, авторами которой были Дебай и Хюккель(1923). При выводе теории они исходили из следующих предположений:
1) В разбавленных растворах сильные электролиты нацело диссоциированы на ионы.
2) Между ионами имеет место только кулоновское электростатическое взаимодействие.
3) Каждый ион в растворе окружён сферой противоположно заряженных ионов.
4) В растворе имеет место статистическое распределение (распределение Больцмана) ионов.
5) Электростатическое взаимодействие рассматривается как взаимодействие центрального иона с его ионной атмосферой.
6) Ионы рассматриваются как бесструктурные шарики, что позволяет пренебречь их размером.
7) Диэлектрическая постоянная растворителя не изменяется с растворением в нём электролита.
Активность компонентов раствора — эффективная (кажущаяся) концентрация компонентов с учётом различных взаимодействий между ними в растворе, то есть с учётом отклонения поведения системы от модели идеального раствора.
Активность
отличается от общей концентрации на
некоторую величину. Отношение активности
(![]() )
к общей концентрации вещества в растворе
называется коэффициентом
активности:
)
к общей концентрации вещества в растворе
называется коэффициентом
активности:
![]()
Коэффициент активности служит мерой отклонения поведения раствора (или компонента раствора) от идеального. Отклонения от идеальности могут быть обусловлены различными химическими и физическими причинами — дипольные взаимодействия, поляризация, образование водородных связей, ассоциация, диссоциация, сольватация и др.[1]
Ионная сила раствора — мера интенсивности электрического поля, создаваемого ионами в растворе. Полусумма произведений из концентрации всех ионов в растворе на квадрат их заряда. Формула впервые была выведена Льюисом:
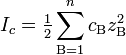 ,
,
где cB — молярные концентрации отдельных ионов (моль/л), zB заряды ионов
Суммирование проводится по всем типам ионов, присутствующих в растворе. Если в растворе присутствуют два или несколько электролитов, то вычисляется общая суммарная ионная сила раствора.
Например, для раствора NaCl с концентрацией 0,001 моль/л, в котором присутствуют два вида однозарядных ионов Na+ и Cl− с концентрациями также равными 0,001 моль/л, ионная сила будет вычисляться следующим образом:
I(NaCl) = 0,5(z²(Na+)•c(Na+) + z²(Cl−)•c(Cl−)) = 0,5(1²•c(NaCl) + (-1)²•c(NaCl)) = c(NaCl)
11.
Диссоциация воды
Чистая вода, хоть и плохо (по сравнению с растворами электролитов), но может проводить электрический ток. Это вызвано способностью молекулы воды распадаться (диссоциировать) на два иона которые и являются проводниками электрического тока в чистой воде (ниже под диссоциацией подразумевается электролитическая диссоциация - распад на ионы):
H2O ↔ H+ + OH-
Примерно на 556 000 000 не диссоциированных молекул воды диссоциирует только 1 молекула, однако это 60 000 000 000 диссоциированных молекул в 1мм3. Диссоциация обратима, то есть ионы H+ и OH- могут снова образовать молекулу воды. В итоге наступает динамическое равновесие при котором количество распавшихся молекул равно количеству образовавшихся из H+ и OH- ионов. Другими словами скорости обоих процессов будут равны.
Ио́нное произведе́ние воды́ — произведение концентраций ионов водорода Н+ и ионов гидроксила OH− в воде или в водных растворах, константа автопротолиза воды.
![]()
Обозначим произведение K·[H2O] = Kв = 1,8·10−16 моль/л·55,56 моль/л = 10−14моль²/л² = [H+]·[OH−] (при 25 °C).
Константа Kв, равная произведению концентраций протонов и гидроксид-ионов, называется ионным произведением воды. Она является постоянной не только для чистой воды, но также и для разбавленных водных растворов веществ. C повышением температуры диссоциация воды увеличивается, следовательно, растёт и Kв, при понижении температуры — наоборот.
