
56) Амины
Амины– это производные аммиака, в котором один, два или все три атома водорода замещены органическими радикалами. Строение и свойства аминов. Известно много органических соединений, в которые азот входит в виде остатка аммиака, например: 1) метиламин СН3-NН2; 2) диметиламин СН3-NH-СН3; 3) фениламин (анилин) С6Н5-NН2; 4) метилэтиамин СН3-NН-C2H5. Все эти соединения относятся к классу аминов. Сходство аминов с аммиаком не только формальное. Они имеют и некоторые общие свойства. 1. Низшие представители аминов предельного ряда газообразны и имеют запах аммиака. 4СН3-NH2 + 9O2 ? 4СO2 + 10Н2О + 2N2. 2. Если амин растворить в воде и раствор испытать лакмусом, то появится щелочная реакция, как и в случае аммиака. 3. Амины имеют характерные свойства оснований. 4. Сходство свойств аминов и аммиака находит объяснение в их электронном строении. 5. В молекуле аммиака из пяти валентных электронов атома азота три участвуют в образовании ковалентных связей с атомами водорода, одна электронная пара остается свободной. 6. Электронное строение аминов аналогично строению аммиака. 7. У атома азота в них имеется также неподеленная пара электронов. В неорганической химии к основаниям относятся вещества, в которых атомы металла соединены с одной или несколькими гидроксильными группами. Но основания – понятие более широкое. Свойства их противоположны свойствам кислот. 8. Амины называются еще органическими основаниями. 9. Являясь основаниями, амины взаимодействуют с кислотами, при этом образуются соли. Эта реакция аналогична реакциям аммиака и также заключается в присоединении протона. Но при сходстве свойств этих веществ как оснований между ними имеются и различия: а) амины – производные предельных углеводородов – оказываются более сильными основаниями, чем аммиак; б) они отличаются от аммиака лишь наличием в молекулах углеводородных радикалов, поэтому видно влияние этих радикалов на атом азота; в) в аминах под влиянием радикала – СН3 электронное облако связи С-N смещается несколько к азоту, электронная плотность на азоте возрастает, и он прочнее удерживает присоединенный ион водорода; г) гидроксильные группы воды от этого становятся более свободными, щелочные свойства раствора усиливаются.
анилин– один из важнейших продуктов химической промышленности; 2) он является исходным веществом для получения многочисленных анилиновых красителей; 3) анилин используется при получении лекарственных веществ, например сульфаниламидных препаратов, взрывчатых веществ, высокомолекулярных соединений и т. д. Открытие профессором Казанского университета Н.Н. Зининым (1842 г.) доступного способа получения анилина имело большое значение для развития химии и химической промышленности. 1. Промышленность органического синтеза началась с производства красителей. 2. Широкое развитие этого производства стало возможным на основе использования реакции получения анилина, известной сейчас в химии под названием реакции Зинина. Основные свойства анилина: а) ароматический амин – анилин имеет большое практическое значение; б) анилин C6H5NH2 – это бесцветная жидкость, которая плохо растворяется в воде; в) имеет светло-коричневую окраску при частичном окислении на воздухе; г) анилин сильно ядовит.Особенности реакции Зинина: 1) эта реакция заключается в восстановлении нитробензола и выражается уравнением: С6Н5-NO2 + 6Н ? С6Н5-NН2 + 2Н2О; 2) распространенным промышленным способом получения анилина является восстановление нитробензола металлами, например железом (чугунными стружками), в кислой среде; 3) восстановление нитросоединений соответствующего строения – это общий способ получения аминов..
57) Аминокислотами называются карбоновые кислоты, в углеводородном радикале которых один или несколько атомов водорода замещены аминогруппами. В зависимости от взаимного расположения карбоксильной и аминогрупп различают a-, b-, g- и т.д. аминокислоты. Например,
b CH3– |
a CH–COOH a- аминопропионовая кислота I NH2 |
b CH2– I NH2 |
a CH2–COOH b- аминопропионовая кислота |
Чаще всего термин "аминокислота" применяют для обозначения карбоновых кислот, аминогруппа которых находится в a- положении, т.е. для a- аминокислот. Общую формулу a- аминокислот можно представить следующим образом:
H2N– |
CH–COOH I R |
В зависимости от природы радикала (R) – аминокислоты делятся на алифатические, ароматические и гетероциклические.
Получение
1) Важнейший источник аминокислот – природные белки, при гидролизе которых образуются смеси a- аминокислот. Разделение этой смеси – довольно сложная задача, однако по обыкновению одна или две аминокислоты образуются в значительно больших количествах, чем все другие, и их удается выделить достаточно просто.
2) Синтез аминокислот из галогенозамещенных кислот действием аммиака
Cl– |
CH–COOH + 2NH3 ® H2N– I R |
CH–COOH + NH4Cl I R |
Химические свойства
1) Некоторые свойства аминокислот, в частности высокая температура плавления, объясняется своеобразным их строением. Кислотная (–COOH) и основная (–NH2) группы в молекуле аминокислоты взаимодействуют друг с другом, образуя внутренние соли (биполярные ионы). Например, для глицина
H2N-CH2-COOH « H3N+-CH2-COO-
|
2) Вследствие наличия в молекулах аминокислот функциональных групп кислотного и основного характера a- аминокислоты являются амфотерными соединениями, т.е. они образуют соли как с кислотами, так и со щелочами.
H2N– |
CH–COOH + HCl ® [H3N+– I R |
CH–COOH]Cl-(хлористоводородная соль a-аминокислоты) I R |
H2N– |
CH–COOH + NaOH ® H2N– I R |
CH–COO-Na+(натриевая соль a-аминокислоты) + H2O I R |
3) В реакции со спиртами образуются сложные эфиры.
 Этиловый
эфир аланина
Этиловый
эфир аланина
4) a- Аминокислоты можно ацилировать, в частности, ацетилировать, действуя уксусным ангидридом или хлористым ацетилом. В результате образуются N- ацильные производные a- аминокислот (символ "N" означает, что ацил связан с атомом азота).
 N
– ацетилаланин
N
– ацетилаланин

Пептиды (греч. рерфпт -- питательный) -- семейство веществ, молекулы которых построены из остатков б-аминокислот, соединённых в цепь пептидными (амидными) связями --C(O)NH--.
Это природные или синтетические соединения, содержащие десятки, сотни или тысячи мономерных звеньев --аминокислот. Полипептиды состоят из сотен аминокислот, в противоположность олигопептидам, состоящим из небольшого числа аминокислот (не более 10-50), и простым пептидам (до 10).
58)
Углеводы
- органические соединения, состоящие
из одной или многих молекул простых
сахаров. Их общую формулу обычно
записывают в виде Сn(Н2О)n (где n - не меньше
трех). Впервые в 1844 г. этот термин ввел
отечественный ученый К. Шмид (1822-1894).
КЛАССИФИКАЦИЯ УГЛЕВОДОВ
Выделяют
три группы углеводов: моносахариды,
или простые сахара (глюкоза, фруктоза);
олигосахариды - соединения, состоящие
из 2-10 последовательно соединенных
молекул простых сахаров (сахароза,
мальтоза); полисахариды, включающие
более 10 молекул сахаров (крахмал,
целлюлоза).
ХИМИЧЕСКИЕ
СВОЙСТВА УГЛЕВОДОВ
Все
моносахариды и некоторые дисахариды,
в том числе мальтоза и лактоза, относятся
к группе редуцирующих (восстанавливающих)
сахаров. Сахароза - нередуцирующий
сахар. Восстановительная способность
сахаров зависит у альдоз от активности
альдегидной группы, а у кетоз - от
активности как кетогруппы, так и
первичных спиртовых групп. У нередуцирующих
сахаров эти группы не могут вступать
в какие-либо реакции, потому что здесь
они участвуют в образовании гликозидной
связи. Две обычные реакции на редуцирующие
сахара - реакция Бенедикта и реакция
Фелинга - основаны на способности этих
сахаров восстанавливать ион двухвалентной
меди до одновалентной. В обеих реакциях
используется щелочной раствор сульфата
меди (2) (CuSO4), который восстанавливается
до нерастворимого оксида меди (1) (Cu2O).
Ионное уравнение: Cu2+ + e = Cu+ дает
синий раствор, кирпично-красный осадок.
Все полисахариды нередуцирующие. Формула
глюкозы C6H12O6.
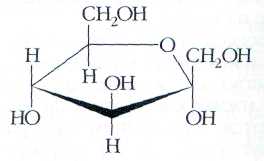
Глюкоза -
моносахарид, одна из восьми изомерных
альдогексоз. Молярная масса 180 г./моль.
Фруктоза (фруктовый
сахар) изомерна глюкозе, но в отличие
от неё относится к кетоспиртам —
соединениям, содержащим кетоновые
и карбонильные группы. Подобно глюкозе,
фруктоза легко образует циклические
полуацетали, только состоят они
преимущественно из пятичленных
циклов:
 В
щелочной среде её молекулы способны
изомеризоваться в глюкозу, поэтому
водные растворы фруктозы восстанавливают
гидроксид меди (II) и оксид серебра
(реакция «серебряного зеркала»).
^ Способы
получения глюкозы:
1.
В процессе фотосинтеза:
hν,
хлорофилл
6СО2 +
6Н2О
→ С6Н12О6 +
6О2
глюкоза
Источником
углеводов в природе служит процесс
фотосинтеза —превращение в зеленых
листьях растений углекислоты воздуха
в углеводы. Энергию для этого процесса
дает солнечный свет. Фотосинтез служит
единственным источником органических
веществ в природе, поскольку животные
не способны синтезировать органические
вещества из неорганических, они лишь
перерабатывают органические вещества,
накопленные растениями. Велика роль
продуктов фотосинтеза и в качестве
источников энергии в промышленности,
поскольку и каменный уголь, и нефть, и
газ, и тем более древесина — все это
«консервированная солнечная энергия»,
накопленная за счет процесса фотосинтеза.
В
щелочной среде её молекулы способны
изомеризоваться в глюкозу, поэтому
водные растворы фруктозы восстанавливают
гидроксид меди (II) и оксид серебра
(реакция «серебряного зеркала»).
^ Способы
получения глюкозы:
1.
В процессе фотосинтеза:
hν,
хлорофилл
6СО2 +
6Н2О
→ С6Н12О6 +
6О2
глюкоза
Источником
углеводов в природе служит процесс
фотосинтеза —превращение в зеленых
листьях растений углекислоты воздуха
в углеводы. Энергию для этого процесса
дает солнечный свет. Фотосинтез служит
единственным источником органических
веществ в природе, поскольку животные
не способны синтезировать органические
вещества из неорганических, они лишь
перерабатывают органические вещества,
накопленные растениями. Велика роль
продуктов фотосинтеза и в качестве
источников энергии в промышленности,
поскольку и каменный уголь, и нефть, и
газ, и тем более древесина — все это
«консервированная солнечная энергия»,
накопленная за счет процесса фотосинтеза.
59) Дисахариды – углеводы, молекулы которых состоят из двух остатков моносахаридов, которые соединены друг с другом за счет взаимодействия двух гидроксильных групп.
В процессе образования молекулы дисахарида происходит отщепление одной молекулы воды:
![]()
или для сахарозы:
![]()
Поэтому молекулярная формула дисахаридов С12H22O11.
Образование сахарозы происходит в клетках растений под воздействием ферментов. Но химики нашли способ осуществления многих реакций, являющихся частью процессов, которые происходят в живой природе. В 1953 году французский химик Р. Лемье впервые осуществил синтез сахарозы, названный современниками «покорением Эвереста органической химии».
В промышленности сахароза получается из сока сахарного тростника (содержание 14-16%), сахарной свеклы (16-21%), а также некоторых других растений, таких как канадский клен или земляная груша.
Всем известно, что сахароза представляет из себя кристаллическое вещество, которое имеет сладкий вкус и хорошо растворимо в воде.
Сок сахарного тростника содержит углевод сахароза, привычно называемый нами сахаром.
Имя немецкого химика и металлурга А. Маргграфа тесно связано с производством сахара из свеклы. Он был одним из первых исследователей, применивших в своих химических исследованиях микроскоп, при помощи которого им были обнаружены кристаллы сахара в свекольном соке в 1747 году.
Лактоза – кристаллический молочный сахар, была получена из молока млекопитающих еще в XVII в. Лактоза является менее сладким дисахаридом, нежели сахароза.
Теперь ознакомимся с углеводами, имеющими более сложное строение – полисахаридами.
Полисахариды – высокомолекулярные углеводы, молекулы которых состоят из множества моносахаридов.
В упрощенном виде общая схема может быть представлена так:
![]()
Теперь сравним строение и свойства крахмала и целлюлозы – важнейших представителей полисахаридов.
Структурное звено полимерных цепей этих полисахаридов, формула которых (С6H10O5)n, – это остатки глюкозы. Для того, чтобы записать состав структурного звена (С6H10O5), нужно отнять молекулу воды из формулы глюкозы.
Целлюлоза и крахмал имеют растительное происхождение. Они образуются из молекул глюкозы в результате поликонденсации.
Уравнение реакции поликонденсации, а также обратного ей процесса гидролиза для полисахаридов условно можно записать следующим образом:
![]()
Молекулы крахмала могут иметь как линейный, так и разветвленный тип строения, молекулы целлюлозы – только линейный.
При взаимодействии с йодом крахмал, в отличие от целлюлозы, дает синее окрашивание. Различные функции эти полисахариды имеют и в растительной клетке. Крахмал служит запасным питательным веществом, целлюлоза выполняет структурную, строительную функцию. Стенки растительных клеток построены из целлюлозы.
