
- •Аннотация
- •Содержание
- •Введение
- •Описание химических источников тока
- •Импульсные преобразователи напряжения
- •Понижающий преобразователь напряжения
- •Повышающий преобразователь напряжения
- •Инвертирующий преобразователь напряжения
- •Расчеты параметров схемы
- •Понижающий преобразователь
- •Инвертирующий преобразователь
- •Повышающий преобразователь
- •Микросхема mc33063
- •Микросхема icl7660
- •Линейный стабилизатор напряжения
- •Микросхема lm317
- •Список использованных источников
МИНОБРНАУКИ РОССИИ
Санкт-Петербургский государственный
электротехнический университет
«ЛЭТИ» им. В.И. Ульянова (Ленина)
Кафедра БТС
Отчет
по учебной практике
Тема: Стабилизаторы напряжения
Студент гр. 7501 _____________________ Гаврилко Е. А.
Студент гр. 7501 _____________________ Исаков А. О.
Преподаватель _____________________ Анисимов А. А.
Санкт-Петербург
2019 г.
ЗАДАНИЕ
Вариант №1
Студенты: Гаврилко Е. А., Исаков А. О.
Группа 7501
Тема работы: Исследование основных принципов работы стабилизаторов напряжения различного принципа действия (линейные, импульсные, с накачкой заряда).
Провести исследование следующих преобразователей напряжения:
1) Микросхемы линейного преобразователя LM317LZ, собрать на её основе понижающий преобразователь с 15 В до 10 В, нагрузка 270 Ом.
2) Микросхемы импульсного преобразователя MC34063AL, собрать на её основе понижающего преобразователя с 15 В до 5 В, нагрузка 270 Ом; повышающий преобразователь с 5В до 15 В, нагрузка 1 кОм; инвентор 5 В до -5 В.
3) Микросхемы преобразователи на переключающихся конденсаторах ICL7660, собрать на её основе инвертор 5 В до -5 В, удвоитель напряжения с 5 В до 10 В, нагрузка 1 кОм.
Дата выдачи задания: 08.07.2019
Дата сдачи отчета: 15.07.2019
Дата защиты отчета: 15.07.2019
Студент гр. 7501 _____________________ Гаврилко Е. А.
Студент гр. 7501 _____________________ Исаков А. О.
Преподаватель _____________________ Анисимов А. А.
Аннотация
Кратко (в 8-10 строк) указать цель и основное содержание практики.
Summary
Briefly (8-10 lines) to describe the the purpose and main contents of the practice work.
Содержание
Введение 4
Описание химических источников тока 6
1.1 Расчет параметров схемы 2
1.1.1 Понижающий преобразователь
1.1.2 Инвентирующий преобразователь
1.2 Сборка схемы на платформе NI-ELVIS 3
2. Схема с переключаемыми конденсаторами 4
3. Линейный стабилизатор напряжения 5
Вывод 6
Введение
Преобразователь – это электротехническое устройство, преобразующее электроэнергию одних параметров или показателей качества в электроэнергию с другими значениями параметров или показателей качества. Параметрами электрической энергии могут являться ток и напряжение, их частота, фаза.
Преобразователи питания делятся на следующие группы:
1) Выпрямитель — устройство, предназначенное для преобразования энергии источника переменного тока в постоянный ток (AC/DC)
2) Инвертор — устройство, задача которого обратна выпрямителю, то есть преобразование энергии источника постоянного тока в энергию переменного тока (DC/AC)
3) Преобразователь напряжения - устройство, предназначенное для преобразования энергии постоянного тока:
-
Повышающий
-
Понижающий
-
Импульсный – работают за счет переключения ключевого элемента
-
Линейный – работают в непрерывном режиме
-
Инвертирующий
4) Трансформатор - устройство, предназначенное для преобразования энергии переменного тока.
В нашем случае рассматриваются преобразователи напряжения.
Преобразователи широко используются в приборах, т. к. современные устройства многосоставные. Ставится задача питания всех частей устройства – как аналоговых, так и цифровых – от одного источника питания. Естественно говорить о различных требованиях к питанию отдельных частей, в связи с чем и появилась необходимость использования преобразователей питания.
Цель работы: изучить разновидности преобразователей напряжения и проверить их работу на практике
Задачи:
1) Изучить теоретический принцип работы каждой из схем
2) Произвести расчет параметров элементов схем
3) Снять необходимые характеристики схем, установить соответствие опытных данных теоретическим
4) Сделать вывод по проделанной работе
Описание химических источников тока
Химические источники тока (ХИТ) – это источники электродвижущей силы (ЭДС), в которых энергия протекающих внутри химических реакций превращается в электрическую энергию.
ХИТ принято подразделять на три основные категории по возможности или невозможности их повторного использования:
-
Первичные гальванические элементы (ПХИТ) – внутри таких
источников происходят химические окислительно-восстановительные реакции (ОВР), энергия которых переходит в электрическую. Данные реакции являются необратимыми, поэтому элементы невозможно перезарядить.
Состоят такие батареи из двух электродов, которые имеют разный электродный потенциал, металлического проводника, по которому могут перемещаться электроны, и электролита, который помогает перемещению ионов между электродами. В их состав входят реагенты (окислители и восстановители), которые участвуют в прямом преобразовании энергии. Выработка тока прекращается после того, как реагенты полностью израсходуются
-
Вторичные ХИТ, электрические аккумуляторы (ВХИТ) – так же
являются гальваническими элементами, однако их особенность заключается в том, что возможна перезарядка с помощью внешнего источника тока. Благодаря этому воздействию, электрическая энергия может переходить в химическую, а при подключении внешней цепи происходит обратный процесс.
В отличие от батарей, которые исчерпывают свою работоспособность при разряде, аккумуляторы могут регенерироваться, то есть повторно накапливать энергию и перезапускать цикл химических реакций.
К вторичным элементам относятся трансформаторные и инверторные преобразователи, выпрямители и т. д.
-
Топливные элементы (электрохимические генераторы) – устройства,
чье основное отличие их от гальванических элементов заключается в том, что вещества, необходимые для электрохимической реакции, подаются внутрь извне, а продукты от реакций, наоборот, удаляются.
Подобный подход позволяет организовать долгую непрерывную работу без фактической перезарядки.
Функции ВХИТ
-
Преобразование формы напряжения (переменного напряжения в постоянное, изменение частоты, формирование импульсов);
-
Преобразование значение напряжения (повышение или понижение его величины, формирование нескольких величин для разных цепей);
-
Стабилизация напряжения (его показатели на выходе должны находиться в заданном диапазоне);
-
Защита (нужно для того, чтобы напряжение, превысившее допустимые значения вследствие неисправности, не вывело из строя аппаратуру или сам ИП);
-
Гальваническое разделение цепей;
-
Обеспечение передачи требуемой мощности с наименьшими потерями;
Сравнение батареек и аккумуляторов.
Батарейка – это наипростейшее устройство для получения электричества, которое представляет собой гальванический элемент. Суть работы элемента составляет метод, основанный на химическом взаимодействии одних веществ с другими.
Первой современной батарейкой по праву можно назвать «Вольтов столб» — устройство, созданное итальянским физиком Алессандро Вольта в 1800 году. «Вольтов столб» представлял собой стопку из пластин разных металлов — цинковых и медных. Между ними клалась ткань, смоченная в кислоте. Химическая реакция между элементами «Вольтова столба» создавала электричество.
Устройство батарейки (на примере щелочного элемента)
В качестве материала для отрицательного электрода применяется цинк, он пропитывается щелочным электролитом. Вывод анода на корпус изготавливается в виде стальной тарелки. Положительный электрод производят из никелированной стали. Для того, чтобы не возникало коротких замыканий необходимо изолировать оболочку. Специальная прокладка удерживает газы, которые образуются в ходе химических реакций, так как их количество незначительно, камера для сбора выполняется малых размеров. В конструкции присутствует предохранительная мембрана, она защищает батарейку от возникновения короткого замыкания. Мембрана прорывается, и излишний электролит вытекает наружу.
Рис.
1. Устройство батарейки
Принцип работы
Любой химический источник питания устроен схожим образом, в нем обязательны три элемента, между которыми происходит химическая реакция, в результате которой возникает электричество:
-
положительного полюса – анода (цинк);
-
отрицательного полюса – катода (марганец);
-
электролит (сухого или жидкого) – раствор, который хорошо проводит электрический ток и представляет собой среду для передвижения ионов, образовавшихся в результате химических реакций. При возникновении реакции через этот раствор начинают взаимодействовать металлы.
Происходит поступление электрического тока с положительного заряда (анода) на отрицательный (катод), из-за чего начинает вырабатываться электрическая энергия. При этом важно помнить, что необходимо присутствие нагрузки: лампочки, двигателя, диода или какого-либо иного элемента. Отсутствие нагрузки во время соединения «плюса» с «минусом» приводит к короткому замыканию. Катоды выступают восстановителем. Они получают электроны от поступившего анода. В процессе эксплуатации аккумуляторов постоянно образуются определенные вещества, аноды же в ходе работы элемента приходят в негодность, разрушаются, окисляются. Таким образом источник питания садится. Важно помнить, что все, что происходит в батарейках – необратимо. Поэтому гальванические элементы не заряжаются.
Виды батареек по составу
Батарейки имеют пять основных видов. Во многом это зависит от того, какие материалы применяются при их производстве. Согласно стандарту IEC (Международная электротехническая комиссия), маркировку гальванических источников тока делают исходя из состава электролита и активного металла, применяющихся в их конструкции. Буква R в их обозначении означает круглую форму (от английского round). Буква «L», которая идет перед «R», говорит о том, что этот элемент щелочного типа/ Буква «С» ставится перед «R», если нужно пояснить, что элемент – литиевый:
• Солевые.
• Щелочные.
• Серебряные.
• Ртутные.
• Литиевые.
Солевые батарейки
Данный тип вошёл в массовое использование намного раньше всех других и поэтому является самым популярным (в том числе благодаря своей низкой стоимости). Состоят солевые батарейки из анода, катода и анодного проводника. электроды выполняются из оксида марганца и цинка. Кроме того, каждый из этих элементов находится в своем электролите – в обоих случаях это хлорид аммония. Контактируют катод и анод с помощью моста, который их соединяет. Чаще всего солевые питательные элементы используются в пультах, часах, игрушках для детей и др. Недостатки: резкое падение напряжения во время разряжения элемента; снижение емкости на 40% в конце допустимого срока хранения, а также при
Алкалиновые батарейки (щелочные)
Называются они так из-за того, что входящий в состав электролит сам состоит из щелочного раствора, который позволяет улучшить срок службы и некоторые важные показатели батарейки. В состав алкалинового источника питания входит не только электролит, но и электроды, которые выполняются из цинка и двуокиси марганца. Такие батарейки обладают запасом мощности среднего уровня и сроком годности до пяти лет. Они устанавливаются в мобильные телефоны, планшеты и другое портативное оборудование.
Существуют щелочные батарейки, которые поддаются подзарядке. Заряженные изначально батарейки называются первичными источниками тока, но после первого разряжения и дальнейшей зарядки они становятся вторичными источниками. Особенностью таких батареек является высокое сопротивление, а также повышенный срок службы. Однако стоимость таких источников питания будет в несколько раз выше, чем стоимость обычных щелочных батареек.
Преимущества щелочных батареек: повышенная емкость, а значит, долгий рабочий период; невосприимчивость к перепаду температуры и ее минусовым значениям; прочный корпус, а значит, они не протекут и не испортят другие детали в устройстве; срок службы составляет до 5 лет; малый саморазряд – не более 10% к первому году.
Щелочные батарейки имеют емкость примерно 1500 – 3200 мА*ч, поэтому их можно использовать в оборудовании повышенного потребления энергии: фотоаппараты, плееры, телефоны и «мыши» от компьютера.
Существуют также алкалиновые батарейки с маркировкой «фото». Как понятно из названия, они предназначены для фотоаппаратов. Их конструкция продумана специально для того, чтобы максимально быстро передавать энергию устройству – это положительно сказывается на качестве полученных фотографий.
Если же вставить щелочной элемент питания в часы или пульт, то они проработают около 2 – 3 лет.
Ртутные батарейки
В 1980-х годах ртутные батарейки были популярны в качестве источников тока для фотоаппаратов, военных приборов, космических аппаратов. В 1982 году по всему миру было распродано около одного миллиона ртутных источников.
Анод у элементов выполняется из цинка, а катод – из оксида ртути. Разделение этих двух электродов осуществляется с помощью диафрагмы, напитанной раствором электролита, и специального сепаратора. В роли электролита берется щелочной раствор с концентрацией 40%. Ртутные батарейки обладают свойством аккумулятора, то есть их можно подзаряжать после разрядки. Однако с увеличением числа циклов заряда–разряда емкость устройства уменьшается. Происходит из-за того, что ртуть слипается в шарики и стекает. Чтобы избежать такого явления, специалисты рекомендуют добавлять гидроксид магния в анод и порошок серебра (до 9%) – в катод. главные отличия ртутных батареек от алкалиновых заключаются в более стабильном напряжении и повышенной емкости. Токсичность ртутных батареек превышает норму, поэтому в 21 веке их производство запретили.
Серебряные батарейки
Состоят из электролита (щелочь – гидроксид натрия или калия), цинкового анода и катода из оксида серебра. Их принцип работы схож с ртутными источниками тока. Обычно серебряные батарейки используют в часах.
по многим характеристикам серебряные батарейки очень похожи на ртутные, а именно: стабильным напряжением, длительным периодом хранения, долгим сроком службы (на 40% больше, чем у литиевых устройств), а также повышенной энергетической плотностью. Однако главное отличие серебряных от ртутных заключается в большей емкости элемента на единицу веса и полным отсутствием токсичности. Батарейки из серебра ввиду своей высокой цены не использовались повсеместно в отличие от других видов элементов питания. Они незаменимы в устройствах, где требуются маленькие порции серебра: в компьютерных платах в вычислительном оборудовании, в дорогих наручных часах, маленьких калькуляторах и пр.
Литиевые батарейки
Литиевые батарейки изобрели совсем недавно. Они состоят из анода, катода из лития и электролита.
отсутствие зависимости емкости от значения тока нагрузки. Это означает, что при очень больших нагрузках по току литиевые элементы продолжат функционировать существенно дольше, нежели их щелочные аналоги. Кроме того, период их хранения очень велик и составляет порядка 11 – 12 лет. Применяются в приборах и устройствах с большим потреблением энергии.
Использование
Значение емкости солевых батареек мало – всего около 700 – 850 мА*ч, что делает их подходящими для устройств с малым потреблением энергии – для пульта ДУ, весов, часов и т. п. Солевые не годятся для работы в мощных приборах, таких как профессиональные фотоаппараты, не подходят для оборудования с электромоторами – например, некоторых игрушек для детей. Они мало подходят, например, для фонариков, плееров – всех приборов с высокой нагрузкой.
Ртутные батарейки ранее (около 25 лет назад) использовались весьма широко – в медицинской технике, например, в кардиостимуляторах, и военном оборудовании. На сегодняшний день их производят намного реже из-за их вреда для человеческого организма и сложной утилизации.
Говоря о портативной медицинской технике
Литиевые батарейки из-за длительного срока работы применяются в мощной технике, которая потребляет большое количество электроэнергии. Именно поэтому такие элементы питания предпочтительны в медицинском, компьютерном оборудовании, а также в военной и авиационной отрасли.
Виды элементов по размеру
Разные устройства требуют использования батареек различных размеров. Существует две классификации размеров источников тока (американская и европейская). В России чаще используется европейская система. На самом же источнике ставится маркировка согласно американской системе, по которой можно определить размер батареи. Кроме того, в большинстве случаев указывается и состав источника.
|
Европейская классификация |
Американская классификация |
Высота, мм |
Ширина, мм |
|
Мини-мизинчиковая |
A23 |
28,9 |
10,5 |
|
Пальчиковая |
AA |
50,5 |
14,5 |
|
Мизинчиковая |
AAA |
44,5 |
10,5 |
|
Маленькая мизинчиковая |
AAAA |
42,5 |
8,3 |
|
Средняя |
C |
50 |
26,2 |
|
Большая |
D |
61,5 |
34,2 |
|
Крона |
PP3 |
48,5 |
26,5 |
Таблица 2. Таблица основных размеров источников тока.
Каждый аккумулятор, вне зависимости от того, к какому виду он относится, обладает следующими основными характеристиками:
-
Емкость – заряд батареи, измеряемый в Амперах в час (А/ч). Определяет продолжительность работы батареи с различными по энергопотреблению приборами и потребителями.
-
Напряжение – разность потенциалов между клеммами АКБ. Колеблется от 2 до 12-24 В (вольт);
-
Размеры – габариты батареи (длина, ширина и высота), измеряемые в сантиметрах;
-
Вес – в зависимости от конструкции и предназначения, вес современных аккумуляторов колеблется от 10-15 грамм до 100 и более килограмм;
-
Диапазон рабочих температур – температурный режим, в котором АКБ может нормально работать в течение всего срока службы;
-
Допустимая глубина (уровень) разряда – минимальное значение напряжения, при котором батарея должна быть поставлена на зарядку. Выражается в процентах относительно напряжения полностью заряженного аккумулятора.
-
Максимальные токи зарядки – значение силы тока, которое необходимо для нормальной и максимально быстрой зарядки АКБ. Значение данной характеристики выражается в процентах от емкости батареи.
-
Саморазряд – ежегодно снижающаяся часть емкости батареи, выражаемая в процентах от первоначальной. Происходит он из-за необратимых химических реакций, протекающих в элементе. Причем саморазряд больше, когда устройство не эксплуатируется – тогда он может достигать до 30% в год от общей емкости элемента (конкретная цифра зависит от типа химической системы, которая используется в батарейке). Кроме того, особенно негативно на разряд элементов влияют резкие перепады температур, а также эксплуатация на морозе;
-
Срок эксплуатации – длительность выполнения батареей своих прямых функций.
|
|
Щелочные (алкаиновые) |
Серебрянно-цинковые |
|
Маркировка |
LR |
SR |
|
Катод |
цинк |
цинк |
|
Анод |
диоксид марганца |
оксид серебра |
|
Электролит |
гидроксид щелочного металла |
гидроксид щелочного металла |
|
Размер/Форма |
|
|
|
Емкость |
средняя |
высокая |
|
Цена |
средняя |
высокая |
|
Срок хранения |
до 5 лет |
до 10 лет |
|
Напряжение |
1,5 В |
1.55 В |
|
Температурный диапазон |
падение до -20 |
до -30 |
|
Область применения |
|
часы |
|
Преимущества |
дешевые, независимость от перепадов температур |
высокое качество, долго хранятся, возможность непрерывной работы при низких температурах |
|
Недостатки |
содержание ртути, большой вес |
высокая стоимость |
|
Таблица 2. Сравнение видов батареек. |
Щелочные (алкаиновые) |
Серебрянно-цинковые |
|
Маркировка |
LR |
SR |
|
Катод |
цинк |
цинк |
|
Анод |
диоксид марганца |
оксид серебра |
|
Электролит |
гидроксид щелочного металла |
гидроксид щелочного металла |
|
Размер/Форма |
|
|
|
Емкость |
средняя |
высокая |
|
Цена |
низкая |
высокая |
|
Срок хранения |
до 5-10 лет |
до 10 лет |
|
Напряжение |
1,5 В |
1.55 В |
|
Температурный диапазон |
падение до -20 |
до -30 |
|
Область применения |
|
часы |
|
Преимущества |
дешевые, активно используются |
высокое качество, долго хранятся |
|
Недостатки |
содержание ртути |
высокая цена |
|
|
Солевые |
Воздушно-цинковые |
Литиевые |
|
Маркировка |
R |
PR |
CR |
|
Катод |
цинк |
цинк |
литий |
|
Анод |
диоксид марганца |
кислород |
диоксид марганца |
|
Электролит |
хлориды аммония и цинка |
гидроксид щелочного металла |
органический |
|
Размер/Форма |
Круглые (R - round) |
|
|
|
Емкость |
небольшая |
высокая (в 10 больше серебрянно-цинковых) |
высокая |
|
Цена |
низкая |
средняя |
высокая |
|
Срок хранения |
низкий (до 2-х лет) |
несколько недель после вскрытия упаковки |
До 8 лет |
|
Напряжение |
1,5 В |
1,2-1,4 В |
3 В |
|
Температурный диапазон |
неработоспособны при низких температурах |
от -20 до +35 |
до -40 |
|
Область применения |
Пульты, часы, электронные весы, бытовые приборы |
|
медицинские устройства (электрокардиостимуляторы), приборы с большим потреблением энергии, портативные гаджеты |
|
Преимущества |
Низкая стоимость исходных материалов и самой батарейки, простое строение |
безопасные |
небольшие размеры, |
|
Недостатки |
Отрицательное влияние перепадов температур на качество работы, возможность протечки гальванического элемента |
необходимо герметизировать для предотвращения саморазряда |
взрывоопасны |
Таблица 2 (продолжение). Сравнение видов батареек.
Аккумулятор — это многоразовый источник тока, который предназначен для накопления и хранения энергии. Он накапливает энергию в химической форме при подключении к источнику постоянного тока, а затем отдает ее, преобразуя в электричество. Его работа основана на обратимых окислительно-восстановительных реакциях, что дает возможность использовать батарею многократно. Для создания аккумуляторной батареи, несколько аккумуляторов соединяют в одну цепь.
Применяются аккумуляторы в качестве автономных и резервных источников питания для электротехнического оборудования и различных устройств.
Устройство
Все элементы располагаются в корпусе, который изготавливают из полипропилена. Корпус состоит из емкости, разделенной на шесть ячеек, и крышки, оснащенной дренажной системой для стравливания давления и отвода газа. На крышку выводится два полюса (клеммы) – положительный и отрицательный.
Содержимое каждой ячейки представляет собой пакет из 16 свинцовых пластин, полярность которых чередуется. Восемь положительных пластин, объединенных бареткой, являются плюсовым электродом (катодом), восемь отрицательных – минусовым (анодом). Каждый электрод выводится к соответствующей клемме аккумулятора.
Между пластинами электродов, для предотвращения замыкания, вставлены сепараторы – пористые пластины, которые не препятствуют циркуляции электролита и не взаимодействуют с ним.
Отдельная пластина электрода – это решетка из металлического свинца, в которую впрессован (намазан) реагент. Активная масса катода – диоксид свинца (PbO2), анода – губчатый свинец.
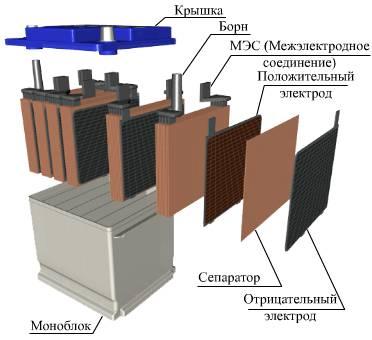
Рис. Устройство аккумулятора.
Принцип действия
Принцип действия аккумулятора основан на образовании разности потенциалов между двумя электродами, погруженными электролит. При подключении нагрузки (электротехнических устройств) к клеммам аккумулятора в реакцию вступают электролит и активные элементы электродов. Происходит процесс перемещения электронов, который, по сути, и является электротоком.
При разряде аккумулятора (подключении нагрузки) губчатый свинец анода выделяет положительные двухвалентные ионы свинца в электролит. Избыточные электроны перемещаются по внешней замкнутой электрической цепи к катоду, где происходит восстановление четырехвалентных ионов свинца до двухвалентных. Ионы кислорода от диоксида свинца катода и ионы водорода из электролита соединяются, образуя молекулы воды. Поэтому плотность электролита понижается.
При заряде происходят обратные реакции. Под воздействием внешнего напряжения ионы двухвалентного свинца положительного электрода отдают по два электрона и окисляются в четырехвалентные. Эти электроны движутся к аноду и нейтрализуют ионы двухвалентного свинца, восстанавливая губчатый свинец. На катоде, путем промежуточных реакций, снова образуется двуокись свинца.
Виды
Никель-кадмиевые (NiCd) аккумуляторы
Никель-металлогидридные (NiMh)
Литий-ионные (LiIon) аккумуляторы
Литий-полимерные (LiPol) аккумуляторы
