
- •27. Классификация растворов. Основные понятия растворов.
- •28.Механизм образования растворов. Сольваты. Гидраты.
- •29. Растворы. Электролиты и неэлектролиты. Способы выражения состава растворов.
- •Способы выражения состава раствора
- •7. Титром – называют число граммов вещества, содержащееся в раствора.
- •30. Гидролиз солей. Константа гидролиза. Рн.
- •27. Классификация растворов. Основные понятия растворов.
- •28.Механизм образования растворов. Сольваты. Гидраты.
- •29. Растворы. Электролиты и неэлектролиты. Способы выражения состава растворов.
- •Способы выражения состава раствора
- •7. Титром – называют число граммов вещества, содержащееся в раствора.
- •30. Гидролиз солей. Константа гидролиза. Рн.
7. Титром – называют число граммов вещества, содержащееся в раствора.
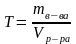 ,
(12)
,
(12)
выражается в г/мл.
30. Гидролиз солей. Константа гидролиза. Рн.
Реакция
чистой воды является нейтральной
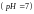 .
Водные растворы кислот и оснований
имеют соответственно кислую
.
Водные растворы кислот и оснований
имеют соответственно кислую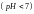 и щелочную
и щелочную
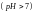 реакцию. Взаимодействие
солей с водой, в результате которого
образуются кислота (или кислая соль) и
основание (или основная соль), называется
гидролизом
солей.
реакцию. Взаимодействие
солей с водой, в результате которого
образуются кислота (или кислая соль) и
основание (или основная соль), называется
гидролизом
солей.
Суть
.Схема
гидролиза: Соли в растворенном состоянии
диссоциируют на ионы, один из видов этих
ионов (катион или анион) химически
реагирует с водой,
связывая
либо катион
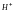 ,
либо анион
,
либо анион
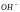 .
В результате этого равновесие диссоциации
самой воды как растворителя смещается
вправо.
.
В результате этого равновесие диссоциации
самой воды как растворителя смещается
вправо.
Причиной гидролиза является электролитическая диссоциация соответствующих солей и воды.
Рассмотрим гидролиз солей следующих основных типов:
1.Соли
сильного основания и сильной кислоты,
при растворении в воде (например,
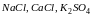 )
не
гидролизуются,
и
раствор соли имеет нейтральную реакцию.
)
не
гидролизуются,
и
раствор соли имеет нейтральную реакцию.
 .
.
2. Соли сильного основания и слабой кислоты, например КСlO, Na2CO3, СН3СООNа, NaCN, Na2S, К2SiO3.
Степень протекания гидролиза увеличивается в ряду анионов:
F−, NO2−, CH3COO−, SO32−, ClO−, CN−, CO32−, PO43−, S2−, SiO44−.
3.
Соли
слабого основания и сильной кислоты,
например
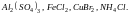
Рассмотрим
гидролиз хлорида железа
(II):
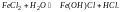
4.Соли
слабого основания и слабой кислоты,
например
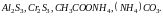
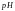 раствора
зависит от соотношения констант
диссоциации кислоты и основания,
образующих соль: если
раствора
зависит от соотношения констант
диссоциации кислоты и основания,
образующих соль: если
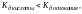 то
то
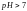 ;
;
если
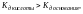 то
то
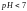 ;
;
если
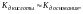 то
то
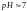 .
.
Константа гидролиза определяет состояние химического равновесия в растворе гидролизованной соли.
KГ - константа гидролиза - константа равновесия обратимой реакции.
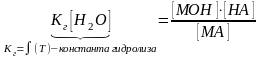
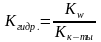 ,
для солей, образованных сильным
основанием и слабой кислотой.
,
для солей, образованных сильным
основанием и слабой кислотой.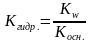 ,
для солей, образованных слабым
основанием и сильной кислотой.
,
для солей, образованных слабым
основанием и сильной кислотой.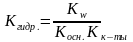 ,
для солей, образованных слабым
основанием и слабой кислотой.
,
для солей, образованных слабым
основанием и слабой кислотой.
Степенью гидролиза h называется отношение количества молекул соли, подвергшихся гидролизу, к общему количеству молекул соли в растворе.
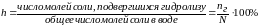
h - степень гидролиза показывает, какая часть соли прогидролизовалась, то - есть превратилась в свои составляющие. Измеряется в процентах или долях единицы.
Очевидно, степень гидролиза h может изменяться в следующих пределах: h = 1 – полный гидролиз, h = 0 – гидролиз отсутствует.
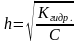
Факторы, влияющие на степень гидролиза: природа и концентрация соли, температура, реакция среды.
а) с увеличением разбавления степень гидролиза увеличивается.
б) с увеличением температуры раствора степень гидролиза сильно возрастает. в) большое влияние на степень гидролиза оказывает и реакция среды (рН).
Водородный показатель представляет собой десятичный логарифм концентрация водородных ионов, взятый с обратным знаком
27. Классификация растворов. Основные понятия растворов.
Раствор – гомогенная система, состоящая из двух или более компонентов, состав которой может непрерывно изменяться в некоторых пределах без скачкообразного изменения её свойств.
Обычно компоненты раствора разделяют на растворитель и растворенное вещество.
Растворителем считается то вещество, количество которого преобладает в данной системе и находится в том же агрегатном состоянии, что и образующийся раствор.
По агрегатному состоянию растворы подразделяются на:
Растворы
Газообразные Например:воздух является раствором О2, Н2, СО2 и т.д. в азоте N2, т.е. растворитель – азот N2 (Воздух можно отнести и к смесям, т.к. компоненты его практически не взаимодействуют между собой) |
Жидкие Г-Ж (кислород в воде) Ж-Ж (спирт в воде) Т-Ж (морская вода) |
Твёрдые Г-Т (водород в платине) Ж-Т (ртуть в серебре) Т-Т (сплавы: серебро в золоте) Нержавеющая сталь представляет собой раствор содержащий 18% Cr, 9% Ni, ≈0,5% C в γ-Fe |
По соотношению преобладания числа частиц, переходящих в раствор и удаляющихся из раствора, различают растворы насыщенные, ненасыщенные и пересыщенные.
Насыщенным называется раствор, находящийся в равновесии с твердой фазой растворенного вещества и содержащий максимально возможное при данных условиях его количество (имеет место динамическое равновесие). (Насыщенный раствор – раствор, находящийся в фазовом равновесии с растворяемым веществом).
Раствор, концентрация которого ниже концентрации насыщенного раствора, называется ненасыщенным.
Пересыщенный раствор – неустойчивый раствор, в котором содержание растворенного вещества больше, чем в насыщенном растворе этого же вещества при тех же значениях температуры и давления.
Состав раствора может быть выражен как качественно, так и количественно. Обычно при качественной оценке растворов применяют такие понятия, как разбавленный и концентрированный; эта оценка весьма условна.
Например, концентрированный раствор H2SO4 – 98 %, и концентрированный раствор HCl – 38%.
Растворы, содержащие большое количество растворенного вещества, называются концентрированными, а с малым содержанием растворенного вещества – разбавленными.
