
- •21) Факторы, влияющие на скорость химической реакции!
- •22) Кинетические уравнения реакций нулевого, первого, второго порядка. Период полураспада!
- •4) Реакции третьего порядка:
- •23) Зависимость скорости реакции от температуры. Уравнение Аррениуса. Энергия активации.
- •24) Скорость химической реакции в однородной среде. Константа скорости.
- •25.Зависимость скорости реакции от температуры. Теория активных столкновений и теория активированного комплекса.
- •26)Гомогенный и гетерогенный катализ!
- •О бразование активированного комплекса в результате взаимодействия образовавшегося промежуточного соединения со вторым компонентом реакции:
- •О бразование конечных продуктов и регенерация катализатора:
- •31) Закон Рауля и следствия из него.
- •35) Электропроводность растворов электролитов!
- •39) Общие свойства металлов.
- •47. Применение электролиза в технике.
- •49. Механизмы коррозии.
26)Гомогенный и гетерогенный катализ!
Гомогенный катализ – каталитические реакции, в которых реагенты и катализатор находятся в одной фазе.
В отсутствии катализатора бимолекулярная реакция протекает по схеме:

В присутствии катализатора реакция имеет другой механизм:
образование промежуточного соединения АК в результате обратимого взаимодействия между катализатором и одним из исходных веществ:
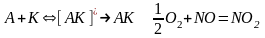
О бразование активированного комплекса в результате взаимодействия образовавшегося промежуточного соединения со вторым компонентом реакции:
О бразование конечных продуктов и регенерация катализатора:
Гетерогенный катализ – каталитические реакции, идущие на поверхности раздела фаз, образуемых катализатором и реагирующими веществами. В каждой гетерогенно-каталитической реакции можно выделить как минимум шесть стадий:
1. Диффузия исходных веществ к поверхности катализатора.
2. Адсорбция исходных веществ на поверхности с образованием некоторого промежуточного соединения:А + В + К ––> АВК
3. Активация адсорбированного состояния (необходимая для этого энергия есть истинная энергия активации процесса):АВК ––> АВК#
4. Распад активированного комплекса с образованием адсорбированных продуктов реакции:АВК# ––> СDК
5. Десорбция продуктов реакции с поверхности катализатора.СDК С + D + К
6. Отвод продуктов от поверхности катализатора путем диффузии.
Таким образом, и в гетерогенном катализе ускоряющее действие катализатора связано с понижением энергии активации, которое происходит за счет образования реагирующими веществами промежуточных поверхностных соединений на активных участках катализатора.
Специфической особенностью гетерокаталитических процессов является способность катализатора к промотированию и отравлению.
Промотирование – увеличение активности катализатора в присутствии веществ, которые сами не являются катализаторами данного процесса (промоторов). Например, для катализируемой металлическим никелем реакции. СО + Н2 ––> СН4 + Н2О
Отравление – резкое снижение активности катализатора в присутствии некоторых веществ (т. н. каталитических ядов).
31) Закон Рауля и следствия из него.
Закон Рауля. Относительное понижение упругости пара растворителя над раствором равно мольной доле растворенного нелетучего компонента.
 барометрическая
формула Больцмана.
барометрическая
формула Больцмана.
Следствия из закона Рауля:
1. Растворение нелетучего компонента в растворителе приводит к расширению температурной области существования жидкой фазы.
2. Понижение температуры замерзания и повышение температуры кипения прямо пропорциональны моляльной концентрации растворенного вещества.
3. Растворы, содержащие одинаковое число молей растворенных веществ в одинаковых молях растворителя, обнаруживают одно и то же понижение температуры замерзания и одно и то же повышение температуры кипения.
Δtкип=Э x Смоляльн, где Э – эбуллиоскопическая константа, +0,52.
Δtзам=К x Смоляльн, где К – криоскопическая константа, равная –1,86.
Эбуллиоскопическая константа – разница между температурой кипения раствора и температурой чистого растворителя.
Криоскопическая константа – разница между температурой замерзания раствора и температурой чистого растворителя.
32) Растворы электролитов. Теория электролитической диссоциации Аррениуса. Электролиты – вещества, которые подвергаются электролитической диссоциации, и вследствие чего их расплавы или растворы проводят электрический ток. К электролитам принадлежат все соли, а также кислотные, основные и амфотерные гидроксиды. Раствор электролита представляет собой смесь молекул растворителя и сольватированных (ионы растворенного вещества, окруженные соответственно ориентированными диполями растворителя) молекул и ионов растворенного вещества. Относительное количество молекул, распавшихся на ионы, характеризующее степень диссоциации электролита α , зависит от природы растворителя, природы и концентрации электролита, температуры, давления и наличия других электролитов в растворе. Процесс распада полярного вещества в растворе на ионы называют электролитической диссоциацией (ионного – ионизацией). По способности к электролитической диссоциации электролиты обычно подразделяют на сильные и слабые. К сильным электролитам обычно относят вещества, которые в растворе практически полностью диссоциированы на ионы. Слабыми электролитами считают вещества, степень диссоциации, которых невелика.
Теория электролитической диссоциации и основанная на ней классификация кислот и оснований в полной мере применимы лишь к водным растворам.
Списать с тетради!
