
- •21) Факторы, влияющие на скорость химической реакции!
- •22) Кинетические уравнения реакций нулевого, первого, второго порядка. Период полураспада!
- •4) Реакции третьего порядка:
- •23) Зависимость скорости реакции от температуры. Уравнение Аррениуса. Энергия активации.
- •24) Скорость химической реакции в однородной среде. Константа скорости.
- •25.Зависимость скорости реакции от температуры. Теория активных столкновений и теория активированного комплекса.
- •26)Гомогенный и гетерогенный катализ!
- •О бразование активированного комплекса в результате взаимодействия образовавшегося промежуточного соединения со вторым компонентом реакции:
- •О бразование конечных продуктов и регенерация катализатора:
- •31) Закон Рауля и следствия из него.
- •35) Электропроводность растворов электролитов!
- •39) Общие свойства металлов.
- •47. Применение электролиза в технике.
- •49. Механизмы коррозии.
21) Факторы, влияющие на скорость химической реакции!

Закон действующих масс (ЗДМ): при постоянной температуре скорость химической реакции пропорциональна произведению концентраций реагирующих веществ, взятых в соответствующих степенях.
Б
где kT – константа скорости при данной температуре (К);
EA – энергия активации; R – газовая постоянная;
Т – температура, К; k0 – предэкспоненциальный множитель.
олее точно отражает зависимость константы скорости реакции от температуры уравнение, предложенное в 1889 г. шведским физико-химиком С.А. Аррениусом
Катализаторы – это вещества, которые изменяют скорость химической реакции, но не входят в состав продуктов реакции.
Катализ – явление изменения скорости химической реакции в присутствии веществ, состояние и количество которых после реакции остаются неизменными.
Различают положительный и отрицательный катализ (соответственно увеличение и уменьшение скорости реакции), хотя часто под термином "катализ" подразумевают только положительный катализ; отрицательный катализ называют ингибированием.
Основные положения теории катализа:
1.Катализаторы применимы только для самопроизвольных процессов. 2.Катализаторы изменяют механизм процесса. 3.Катализаторы не меняют тепловой эффект процесса.
4.Катализаторы не влияют на химическое равновесие. 5.Катализаторы селективны. Специфичность катализатора заключается в его способности ускорять только одну реакцию или группу однотипных реакций и не влиять на скорость других реакций. Так, например, многие переходные металлы (платина, медь, никель, железо и т.д.) являются катализаторами для процессов гидрирования; оксид алюминия катализирует реакции гидратации и т.д.
Селективность катализатора – способность ускорять одну из возможных при данных условиях параллельных реакций. Благодаря этому можно, применяя различные катализаторы, из одних и тех же исходных веществ получать различные продукты:
[Cu]: СО + Н2 ––> СН3ОН |
[Al2О3]: С2Н5ОН ––> С2Н4 + Н2О |
[Ni]: СО + Н2 ––> СН4 + Н2О |
[Cu]: С2Н5ОН ––> СН3СНО + Н2 |
Гомогенный катализ – каталитические реакции, в которых реагенты и катализатор находятся в одной фазе.
Автокатализ – процесс каталитического ускорения химической реакции одним из её продуктов.
Гетерогенный катализ – каталитические реакции, идущие на поверхности раздела фаз, образуемых катализатором и реагирующими веществами.
Ферментативный катализ – каталитические реакции, протекающие с участием ферментов – биологических катализаторов белковой природы.
22) Кинетические уравнения реакций нулевого, первого, второго порядка. Период полураспада!
Формальная кинетика – раздел химической кинетики, в котором рассматривается количественное описание хода химической реакции во времени при постоянной температуре в зависимости от концентрации реагирующих веществ.
1) Реакции нулевого порядка. Нулевой порядок реакции указывает на независимость в данном случае скорости реакции от концентрации реагирующего вещества. Такая закономерность возможна, если:
а) концентрация реагента автоматически поддерживается постоянной, как, например, в насыщенном растворе, находящемся в контакте с избытком нерастворенного вещества;
 б)
когда скорость реакции определяется
не концентрацией реагирующего вещества,
которая оказывается достаточно большой
и мало меняется в ходе процесса, а
некоторыми другими ограничивающими
факторами: количеством поглощенного
света или количеством катализатора.
б)
когда скорость реакции определяется
не концентрацией реагирующего вещества,
которая оказывается достаточно большой
и мало меняется в ходе процесса, а
некоторыми другими ограничивающими
факторами: количеством поглощенного
света или количеством катализатора.
Период
полураспада
– это время, в течение которого распадется
половина исходного вещества,
В реакциях нулевого порядка (А®продукты) скорость постоянна и не зависит от времени.
 C
C
tgj = k0
C0
j
t
2
 )
Реакции первого порядка.
)
Реакции первого порядка.
 lnC
lnC
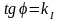
lnC0 j
t
3) Реакции второго порядка:
А+В® продукты,
выражение скорости имеет вид =kIICACB.
а )
CA
=
C0A-x
и
CB
=
C0B
-
x.
)
CA
=
C0A-x
и
CB
=
C0B
-
x.
б) Если а = b и C0A= C0B

П ериод
полураспада:
ериод
полураспада:
1/C

j

1/C0 tgj = kII
t
