
- •План характеристики элемента по положению в Периодической системе д.И. Менделеева
- •Пример характеристики элемента по положению в Периодической системе д. И. Менделеева
- •3 Химическая связь и строение молекул:
- •Ковалентные связи углерода
- •4 Энергетика химических процессов
- •Закон Гесса
- •5 Химическая кинетика
- •Определение константы скорости химической реакции
- •Гомогенный катализ
- •Гетерогенный катализ
- •6 Химическое равновесие
- •7 Растворы
- • Закон Рауля
- •Способы выражения концентрации раствора
- •Ионные реакции в растворах
- •8 Водородный показатель и гидролиз солей
- •Диссоциация воды
- •1.2. Водородный показатель - рН
- •1.3. Сильные и слабые электролиты
- •1.4. Гидролиз солей
- •1.5. Количественные характеристики гидролиза
- •9 Окислительно-восстановительные процессы
- •10 Коррозия металлов
- •1. Коррозия металлов
- •2. Методы защиты металлов от коррозии
- •11 Дисперсные системы
- •12 Вяжущие вещества
- •1.3.2. Глиноземистый цемент
- •3.Коррозия бетона и меры борьбы с ней
- •4. Методы предотвращенияи снижения степени коррозии бетона
Закон Гесса
Пользуясь
табличными значениями ![]()
![]() и
и ![]() ,
можно рассчитать энтальпии различных
химических процессов и фазовых
превращений. Основанием для таких
расчетов является закон
Гесса,
сформулированный петербургским
профессором Г.
И. Гессом (1841
г.): «Тепловой
эффект (энтальпия) процесса зависит
только от начального и конечного
состояния и не зависит от пути перехода
его из одного состояния в другое».
,
можно рассчитать энтальпии различных
химических процессов и фазовых
превращений. Основанием для таких
расчетов является закон
Гесса,
сформулированный петербургским
профессором Г.
И. Гессом (1841
г.): «Тепловой
эффект (энтальпия) процесса зависит
только от начального и конечного
состояния и не зависит от пути перехода
его из одного состояния в другое».
Анализ закона Гесса позволяет сформулировать следующие следствия:
Энтальпия реакции равна разности сумм энтальпий образования конечных и начальных участников реакций с учетом их стехиометрических коэффициентов.
ΔH = ΣΔHобр.конечн – ΣΔHобр.нач
Энтальпия реакции равна разности сумм энтальпий сгорания начальных и конечных реагентов с учетом их стехиометрических коэффициентов.
ΔH = ΣΔHсгор.нач – ΣΔHсгор.конечн
Энтальпия реакции равна разности сумм энергий связей Eсв исходных и конечных реагентов с учетом их стехиометрических коэффициентов.
В ходе химической реакции энергия затрачивается на разрушение связей в исходных веществах (ΣEисх) и выделяется при образованиии продуктов реакции (–ΣEпрод). Отсюда
ΔH° = ΣEисх – ΣEпрод |
Следовательно, экзотермический эффект реакции свидетельствует о том, что образуются соединения с более прочными связями, чем исходные. В случае эндотермической реакции, наоборот, прочнее исходные вещества.
При определении энтальпии реакции по энергиям связей уравнение реакции пишут с помощью структурных формул для удобства определения числа и характера связей.
Энтальпия реакции образования вещества равна энтальпии реакции разложения его до исходных веществ с обратным знаком.
ΔHобр = –ΔHразл
Энтальпия гидратации равна разности энтальпий растворения безводной соли
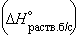 и
кристаллогидрата
и
кристаллогидрата 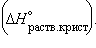
Теплота образования, тепловой эффект реакции образования вещества из каких-либо исходных веществ. Различают: Т. о. из свободных атомов; Т. о. из простых веществ, отвечающих наиболее устойчивому состоянию элементов при данных давлении и температуре; теплоту сольватации, то есть Т. о. сольватных оболочек вокруг ионов при взаимодействии веществ с растворителем; теплоту кристаллизации, то есть Т. о. кристаллов из частиц (атомов, молекул, ионов), образующих решётку кристаллов, и т. д. Наиболее широко используют Т. о. из простых веществ и Т. о. из свободных атомов (или противоположную ей по знаку теплоту атомизации, то есть распада молекулы вещества на составляющие её атомы). Эти величины, как правило, приводятся для веществ в стандартных состояниях.
Определение Т. о. может быть выполнено различными способами: прямыми (калориметрическими) измерениями; по температурной зависимости константы равновесия реакции образования с помощью изобары или изохоры уравнения; вычислением из теплового эффекта реакции, в которой участвует данное вещество, при условии, что известны Т. о. остальных реагентов и продуктов реакции (с помощью Гесса закона); по гиббсовой энергии и энтропии всех реагентов; из изменения ЭДС гальванического элемента при различных температурах с помощью уравнения Гиббса — Гельмгольца; расчётом на основе многочисленных закономерностей для Т. о. различных веществ. Надёжные экспериментальные данные по Т. о. известны приблизительно для 5000 соединений. Имеющиеся величины Т. о. позволяют определять тепловые эффекты многих десятков тысяч реакций без проведения опытов. Совместно с др. данными термодинамики химической они служат основой для расчёта изменений гиббсовой энергии, позволяющих судить о стабильности и сравнительной устойчивости различных химических соединений.
Для большого числа веществ Т. о. могут быть с хорошей степенью точности оценены с помощью закономерностей, связывающих Т. о. со строением веществ и установленных при анализе обширного экспериментального материала на основе классической теории строения химических соединений и квантовой механики молекул (см. Квантовая химия). Эти закономерности используют периодичность свойств однотипных соединений групп и периодов периодической системы элементов Д. И. Менделеева и приближённое постоянство строения и свойств отдельных структурных фрагментов молекул в гомологических рядах.
Первое
следствие закона Гесса.
Энтальпия химической реакции равна
сумме энтальпий образования продуктов
реакции за вычетом суммы энтальпий
образования исходных веществ. Энтальпия
образования вещества В() это энтальпия
реакции образования 1 моль соединения
из простых веществ, устойчивых при
стандартных условиях. Например.
энтальпия образования нитрата натрия
равна энтальпии реакцииNa(кр) + ½N2(г) +
3/2О2(г) = NaNO3(кр), ![]() Энтальпия
образования простых веществ при
стандартных условиях принята равной
нулю. Энтальпия является свойством
вещества, также как и масса, объем и т.д.
Энтальпия _ функция состояния
системы, т.е. ее изменение не зависит от
пути процесса, а определяется только
состоянием системы в конце и начале
процесса.
Энтальпия
образования простых веществ при
стандартных условиях принята равной
нулю. Энтальпия является свойством
вещества, также как и масса, объем и т.д.
Энтальпия _ функция состояния
системы, т.е. ее изменение не зависит от
пути процесса, а определяется только
состоянием системы в конце и начале
процесса.
Энтальпия химической реакции в общем виде аА + bB = dD + eE (2.10)
определяется
по уравнению ![]()
Второе следствие закона Гесса. Энтальпия химической реакции равна сумме энтальпий сгорания исходных веществ за вычетом суммы энтальпий сгорания продуктов реакции.
Энтальпия
сгорания вещества В ![]() это
энтальпия реакции окисления кислородом
1 моль соединения до образования
высших оксидов. Например энтальпия
реакции сгорания метанола есть изменение
энтальпии следующей реакции: СН3ОН +
3/2О2 = СО2 + 2Н2О
это
энтальпия реакции окисления кислородом
1 моль соединения до образования
высших оксидов. Например энтальпия
реакции сгорания метанола есть изменение
энтальпии следующей реакции: СН3ОН +
3/2О2 = СО2 + 2Н2О
Энтальпия химической реакции в общем виде (2.10) определяется по уравнению
![]()
Условия самопроизвольного протекания процессов в закрытых системах:
Изобарно-изотермические (P = const, T = const):
ΔG < 0, dG < 0
ΔF < 0, dF < 0
Процессы, которые сопровождаются увеличением термодинамических потенциалов, протекают лишь при совершении работы извне над системой. В химии наиболее часто используется изобарно-изотермический потенциал, поскольку большинство химических (и биологических) процессов происходят при постоянном давлении. Для химических процессов величину ΔG можно рассчитать, зная ΔH и ΔS процесса, по уравнению (I.75), либо пользуясь таблицами стандартных термодинамических потенциалов образования веществ ΔG°обр; в этом случае ΔG° реакции рассчитывается аналогично ΔН° по уравнению (I.77):
![]() (I.77)
(I.77)
Величина стандартного изменения изобарно-изотермического потенциала в ходе химической любой реакции ΔG°298 есть мера химического сродства исходных веществ. Основываясь на уравнении (I.75), можно оценить вклад энтальпийного и энтропийного факторов в величину ΔG и сделать некоторые обобщающие заключения о возможности самопроизвольного протекания химических процессов, основываясь на знаке величин ΔН и ΔS.
1. Экзотермические реакции; ΔH < 0.
а) Если ΔS > 0, то ΔG всегда отрицательно; экзотермические реакции, сопровождающиеся увеличением энтропии, всегда протекают самопроизвольно.
б) Если ΔS < 0, реакция будет идти самопроизвольно при ΔН > TΔS (низкие температуры).
2. Эндотермические реакции; ΔH > 0.
а) Если ΔS > 0, процесс будет самопроизвольным при ΔН < TΔS (высокие температуры).
б) Если ΔS < 0, то ΔG всегда положительно; самопроизвольное протекание эндотермических реакций, сопровождающихся уменьшением энтропии, невозможно.
ТЕРМОХИМИЯ, раздел химической термодинамики, включающий определение теплового эффекта реакции и установление его зависимости от физ.-хим. параметров. В задачу термохимии входит также измерение и вычисление теплот фазовых переходов, растворения, разбавления и др. процессов, изучение теплоемкостей, энтальпий и энтропии в-в. Осн. эксперим. метод термохимии -калориметрия. Иногда используют некалоримет-рич. методы (расчет тепловых эффектов из результатов измерения констант равновесия, эдс и т.п.), однако в этих случаях результаты обычно менее точны.
Эндотерми́ческие
реа́кции (от др.-греч. ἔνδον —
внутри и θέρμη —
тепло) — химические реакции,
сопровождающиеся поглощением теплоты.
Для эндотермических реакций
изменение энтальпии и внутренней
энергии имеют
положительные значения (![]() ,
, ![]() ),
таким образом, продукты реакции содержат
больше энергии, чем исходные компоненты.
),
таким образом, продукты реакции содержат
больше энергии, чем исходные компоненты.
К эндотермическим реакциям относятся:
реакции восстановления металлов из оксидов,
электролиза (поглощается электрическая энергия),
электролитической диссоциации (например, растворение солей в воде),
ионизации,
фотосинтеза.
Экзотермическая реакция — химическая реакция, сопровождающаяся выделением теплоты. Противоположна эндотермической реакции.
Полное количество энергии в химической системе чрезвычайно трудно измерить или подсчитать. С другой стороны, изменение энтальпии ΔH в химической реакции гораздо легче измерить или сосчитать. Для этих целей используют калориметры. Измеренное значение ΔH соотносится сэнергией связи молекул следующим образом:
ΔH = энергия, потраченная на разрыв связей (Энергия разрыва химической связи)— энергия, выделенная при образовании связей продуктов реакции.
Для экзотермических реакций эта формула даёт отрицательное значение для ΔH, так как большее значение вычитается из меньшего значения.
