
- •План характеристики элемента по положению в Периодической системе д.И. Менделеева
- •Пример характеристики элемента по положению в Периодической системе д. И. Менделеева
- •3 Химическая связь и строение молекул:
- •Ковалентные связи углерода
- •4 Энергетика химических процессов
- •Закон Гесса
- •5 Химическая кинетика
- •Определение константы скорости химической реакции
- •Гомогенный катализ
- •Гетерогенный катализ
- •6 Химическое равновесие
- •7 Растворы
- • Закон Рауля
- •Способы выражения концентрации раствора
- •Ионные реакции в растворах
- •8 Водородный показатель и гидролиз солей
- •Диссоциация воды
- •1.2. Водородный показатель - рН
- •1.3. Сильные и слабые электролиты
- •1.4. Гидролиз солей
- •1.5. Количественные характеристики гидролиза
- •9 Окислительно-восстановительные процессы
- •10 Коррозия металлов
- •1. Коррозия металлов
- •2. Методы защиты металлов от коррозии
- •11 Дисперсные системы
- •12 Вяжущие вещества
- •1.3.2. Глиноземистый цемент
- •3.Коррозия бетона и меры борьбы с ней
- •4. Методы предотвращенияи снижения степени коррозии бетона
1.2. Водородный показатель - рН
Для количественной характеристики реакции среды обычно приводят не концентрации водородных ионов, а применяют некоторый условный показатель, обозначаемый через рН и называемый водородным показателем. Он представляет собой отрицательный десятичный логарифм концентрации катионов водорода рН = - lg [H+].
Для нейтральной среды рН = -lg 10 -7 = 7;
для кислотной - рН < 7;
для щелочной - рН >7.
Аналогично вводится понятие гидроксильного показателя рОН = - lg [ОH-].
рН + рОН = 14.
Определение рН имеет колоссальное значение в технике и, в частности, в строительном деле. Обычно величину рН измеряют при помощи индикаторов - веществ, способных менять свою окраску в зависимости от концентрации ионов водорода. Индикаторами являются слабые кислоты и основания, молекулы и ионы которых окрашены в разный цвет (табл. 1).
Таблица 1
-
Индикаторы
Реакция среды раствора
Кислая
рН < 7
Нейтральная
рН = 7
Щелочная
рН > 7
Лакмус
Красный
Синий
Синий
Фенолфталеин
Бесцветный
Бесцветный
Малиновый
Метиловый
оранжевый
Розовый
Оранжевый
Желтый
Однако индикаторы дают не точное определение значения рН, поэтому современные измерения рН производятся при использовании электрохимических методов, точность которых составляет ±0,01 единицы рН.
Шкала водородного показателя
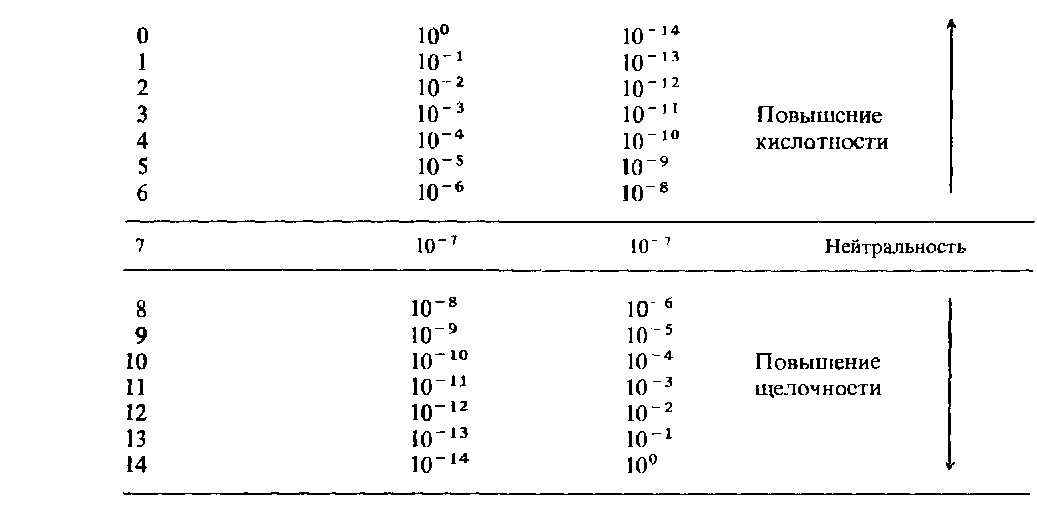
Пример 1. Вычислить рН раствора, в котором концентрация ионов ОН- равна 1∙10-9 моль/л.
Решение. Из соотношения рН + рОН = 14 находим, что рН = 14 – рОН. Так как рОН = - lg [ОH-], то рН = 14 – (-lg 10-9) = 5.
1.3. Сильные и слабые электролиты
Перед тем как рассматривать процесс гидролиза необходимо вспомнить сильные и слабые кислоты и основания. Так как каждая соль это продукт взаимодействия кислоты и основания, то от того какими электролитами эта соль образована будет зависеть как она будет подвергаться гидролизу (табл. 2).
К сильным электролитам относятся соединения, которые характеризуются степенью диссоциации α > 30%.
Таблица 2
Таблица сильных кислот и оснований
-
Кислоты
α %, в 0,1 н р-ре
Основания
α %, в 0,1 н р-ре
HCl
HBr
HJ
HNO3
HClO4
H2SO4
92
92
92
92
92
58
NaOH
KOH
LiOH
Ca(OH)2
Ba(OH)2
91
91
91
77
77
1.4. Гидролиз солей
Гидролизом называют реакции взаимодействия вещества с водой, приводящие к образованию слабых электролитов (кислот, оснований, кислых или основных солей). Результат гидролиза можно расценивать как нарушение равновесия диссоциации воды. Гидролизу подвержены соединения различных классов, но наиболее важным случаем является гидролиз солей. Соли, как правило, - сильные электролиты, которые подвергаются полной диссоциации на ионы и могут взаимодействовать с ионами воды. Степень гидролиза зависит от температуры, концентрации раствора и природы растворенного вещества. Так, если рассмотреть гидролиз cоли СН3СООNа, то степень ее гидролиза для растворов различной концентрации будет следующая: для 1М раствора – 0,003%, для 0,1М – 0,01%, для 0,01М – 0,03%, для 0,001М – 0,1% (данные взяты из книги Г.Реми). Эти значения согласуются с принципом Ле Шателье. Повышение температуры увеличивает кинетическую энергию молекул, их распад на катионы и анионы и взаимодействие с ионами воды (Н+ и ОН–) – слабого при комнатной температуре электролита.
