
- •1.Теория химического строения органических соединений а.М. Бутлерова
- •2. Строение атома углерода. Типы гибридизаций
- •3,4. Классификация и характеристика органических соединений.
- •III. По типу реагента реакции делятся на:
- •5. Изомерия. Виды изомерии.
- •6. Гомологические ряды органических соединений
- •7. Предельные углеводороды.Номенклатура алканов,изомерия,получение,физические свойства и химические свойства,применение.
- •8. Непредельные углеводороды ряда этилен.
- •9.Диеновые ув.
- •10.Непредельные ув ряда ацителена.
- •11. Ароматические углеводороды (арены)
- •13.Одноатомные спирты
- •14.Водородная связь в кислородосодержащих органических соединениях.
- •15. Многоатомные спирты
- •16. Фенолы
- •17. Альдегиды и их химические свойства
- •18. Одноосновные карбоновые кислоты
- •19. Сложные эфиры
- •20.Амины.
- •21.Аминокислоты
- •22. Гетероциклические соединения.Азотосодержащие орг.Соед….
- •23.Вмс.Мономеры,оигомеры,полимеры.
- •24. По характеру процессов
17. Альдегиды и их химические свойства
Карбонильные соединения (оксосоединения) – это производные УВ, содержащие в молекуле карбонильную группу >С = О.
Альдегиды – это органические соединения, молекулы которых содержат альдегидную группу связанную с углеводородным радикалом.
 альдегидная
группа
альдегидная
группа
Их характеристики: 1) общая формула СnH2nО; 2) карбонильный атом углерода находятся в sp2-гибридизации; 3) за счет электронных эффектов двойная связь С=О оказывается сильно поляризованной, что и объясняет высокую реакционную способность альдегидов.
Гомологический ряд предельных альдегидов: НСОН – метаналь (муравьиный альдегид), СН3СОН – этаналь (уксусный альдегид) и т.д.
Изомерия: 1) углеродного скелета; 2) межклассовая (изомерны кетонам); 3) оптическая; 4) кето-енольная таутомерия.
Физические свойства. При обычных условиях НСОН – газ, С2 ... С12 – жидкости, с С13 – твердые вещества. Низшие альдегиды имеют резкий запах, высшие альдегиды, содержащие 8–12 атомов «С», – душистые вещества. Альдегиды раздражают слизистые оболочки глаз и верхних дыхательных путей, вредно влияют на нервную систему.
Химические свойства.
I. Реакции присоединения (AN):
1. Гидрирование:

2. Присоединение спиртов с образованием полуацеталей (неполные простые эфиры двухатомных спиртов, содержащих ОН-группы у одного атома углерода):
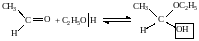
1-этоксиэтанол–1 (полуацеталь)
Гидроксильная группа полуацеталей (полуацетальный гидроксил) очень реакционноспособна. В присутствии катализатора – хлороводорода НС1 и в избытке спирта образуются ацетали RCH(OR')2 – полные простые эфиры двухатомных спиртов:

1,1-диэтоксиэтан (ацеталь)
3. Присоединение гидросульфита натрия NaHSO3:
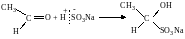
гидросульфитное производное этаналя
II. Реакции окисления.
1. Взаимодействие с аммиачным раствором оксида серебра (I) – «реакция серебряного зеркала».
2AgNO3 + 2NH4OH →Ag2O + 2NH4NO3 + H2O;
2. Взаимодействие с гидроксидом меди (II). Для реакции используют свежеприготовленный Сu(ОН)2. Реакция является качественной на альдегиды.

кирпично-красный осадок
III. Реакции полимеризации (характерны для низших альдегидов).
1. Линейная полимеризация
2.
Циклическая полимеризация (тримеризация,
тетрамеризация).

триоксан (триоксиметилен)
Уксусный альдегид образует циклические тример и тетрамер.
IV. Реакции поликонденсации.
Реакции поликонденсации – это процессы образования высокомолекулярных веществ, в ходе которых соединение исходных мономерных молекул сопровождается выделением таких низкомолекулярных продуктов, как Н2О, НCl, NH3 и т. д.
В кислой или щелочной среде при нагревании формальдегид образует с фенолом фенолформальдегидные смолы различного строения:

Получение альдегидов.
Общие методы получения:
1. Окисление первичных спиртов:
- каталитическое:

- под действием окислителей (К2Сr2O7 или КМnO4 в кислой среде):

2. Каталитическое дегидрирование первичных спиртов:

3. Гидролиз дигалогеналканов, содержащих два атома галогена у первого углеродного атома:

18. Одноосновные карбоновые кислоты
Карбоновые кислоты – это производные УВ, содержащие в молекуле одну или несколько карбоксильных групп –COOH. Карбоксильная группа (карбоксил) – сложная функциональная группа, состоящая из карбонильной и гидроксильной групп:

Количество карбоксильных групп определяет основность кислоты.
Характеристики карбоновых кислот: 1) общая формула СnН2nO2; 2) карбоксильный атом углерода находятся в sp2-гибридизации; 3) связь С=О сильно поляризована, свойства гидроксильной и карбонильной групп в карбоновых кислотах отличаются от свойств соответствующих групп в спиртах и альдегидах; 4) диссоциируют с образованием Н+; 5) не характерны реакции присоединения по связи С=О.
Гомологический ряд предельных карбоновых кислот: НСООН – метановая (муравьиная) кислота, СН3СООН – этановая (уксусная) кислота, СН3(СН2)2СООН – бутановая (масляная) кислота и т.д.
Изомерия: 1) углеродного скелета; 2) межклассовая (изомерны сложным эфирам); 3) оптическая.
Физические свойства. При обычных условиях С1...С9 – жидкости, с С10 ...– твердые вещества. В твердом и жидком состояниях молекулы насыщенных монокарбоновых кислот димеризуются в результате образования между ними водородных связей:

Водородная связь в кислотах сильнее, чем в спиртах. В водных растворах кислоты образуют линейные димеры.
Химические свойства.
I. Кислотные свойства.
1. Диссоциация.

Карбоновые кислоты – слабые кислоты. В гомологическом ряду кислот их сила уменьшается с ростом числа атомов углерода в молекуле:
2. Взаимодействие с активными металлами, основными оксидами, щелочами (р. нейтрализации), аммиаком, солями более слабых кислот.
2НСООН + Са → (HCOO)2Са + Н2↑;
формиат кальция
II. Реакции замещения (SN) ОН-группы.
1. Взаимодействие со спиртами.
2. Взаимодействие с аммиаком с образованием амидов кислот.

ацетамид
3. Взаимодействие с галогенидами фосфора (РС15, РСl5) или тионилхлоридом SOCl2 с образованием галогенангидридов.
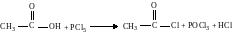
ацетилхлорид
4. Межмолекулярная дегидратация карбоновых кислот:

уксусный ангидрид (ангидрид уксусной кислоты)
III. Реакции замещения у α-углеродного атома. Атомы водорода у α-углеродного атома более подвижны, чем другие атомы водорода в радикале кислоты, и могут замещаться на атомы галогена с образованием α-галогенкарбоновых кислот:

Особенности строения и свойств муравьиной кислоты
Муравьиная (метановая) кислота НСООН по своему строению и свойствам отличается от остальных предельных монокарбоновых кислот.
Получение карбоновых кислот.
1. Общие способы получения:
- окисление первичных спиртов и альдегидов под действием различных окислителей:

- окисление алканов кислородом воздуха (в присутствии Мn2+ или при нагревании под давлением). Обычно образуется смесь кислот. При окислении бутана единственным продуктом является уксусная кислота:

- омыление сложных эфиров (т.е. их щелочной гидролиз):

- гидролиз галогенангидридов кислот:

