
- •1.Теория химического строения органических соединений а.М. Бутлерова
- •2. Строение атома углерода. Типы гибридизаций
- •3,4. Классификация и характеристика органических соединений.
- •III. По типу реагента реакции делятся на:
- •5. Изомерия. Виды изомерии.
- •6. Гомологические ряды органических соединений
- •7. Предельные углеводороды.Номенклатура алканов,изомерия,получение,физические свойства и химические свойства,применение.
- •8. Непредельные углеводороды ряда этилен.
- •9.Диеновые ув.
- •10.Непредельные ув ряда ацителена.
- •11. Ароматические углеводороды (арены)
- •13.Одноатомные спирты
- •14.Водородная связь в кислородосодержащих органических соединениях.
- •15. Многоатомные спирты
- •16. Фенолы
- •17. Альдегиды и их химические свойства
- •18. Одноосновные карбоновые кислоты
- •19. Сложные эфиры
- •20.Амины.
- •21.Аминокислоты
- •22. Гетероциклические соединения.Азотосодержащие орг.Соед….
- •23.Вмс.Мономеры,оигомеры,полимеры.
- •24. По характеру процессов
III. По типу реагента реакции делятся на:
1) Нуклеофильные реакции (N). В таких реакциях реагент (нуклеофил) имеет на одном из атомов свободную пару электронов и является нейтральной молекулой или анионом (Hal-, OH-, RO-, RS-, RCOO-, R-, CN-, H2O, ROH, NH3, RNH2 и др.).
2) Электрофильные реакции (Е). Атакующий реагент (электрофил) имеет вакантную орбиталь и является нейтральной молекулой или катионом (Cl2, SO3, BF3, H+, Br+, R+, NO2+, и др.). Электрофил представляет незаполненные, вакантные орбитали для образования ковалентной связи за счет электронов той частицы, с которой он взаимодействует.
3) Радикальные реакции (R). В таких реакциях атакующим агентом является свободный радикал, образующийся при гомолитическом разрыве химической связи.
5. Изомерия. Виды изомерии.
Все изомеры делят на две большие группы – структурные изомеры и пространственные изомеры. Структурные изомеры отличаются друг от друга порядком соединения атомов. В пространственных изомерах порядок соединения атомов один и тот же, но атомы благодаря электронным или геометрическим особенностям отличаются положением в пространстве относительно других атомов.
Среди структурных изомеров выделяют три группы:
1. Изомеры, принадлежащие одному классу соединений, но отличающиеся строением углеродных скелетов, например:
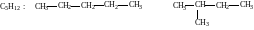
пентан 2-метилбутан
Этот вид изомерии характерен для всех классов органических соединений.
2. Изомеры, принадлежащие одному классу соединений, отличающиеся положением функциональной группы:

1-хлорпропан 2-хлорпропан
или кратной связи в молекуле:

3-метилбутен–1 3-метилбутен–2
Этот вид изомерии характерен для всех классов органических соединений, кроме предельных углеводородов.
3. Изомеры, относящиеся к различным классам органических соединений (межклассовые изомеры), например:
СН3СООН НСООСН3
уксусная кислота метилацетат
Единственный класс органических соединений, представители которого не имеют межклассовых изомеров, это – алканы (предельные алифатические углеводороды).
Пространственные изомеры (стереоизомеры) можно разделить на два класса: цис-транс-изомеры и оптические изомеры.
1. Цис-транс-изомерия характерна для соединений, содержащих двойную связь или цикл. В таких молекулах отсутствует свободное вращение вокруг связи С = С или С – С (в циклах) и заместители у двух соседних атомов углерода могут оказаться по одну сторону (цис-) или по разные стороны (транс-) от плоскости, проходящей через двойную связь:
Цис- и транс-изомеры могут заметно отличаться друг от друга по своим физическим и химическим свойствам.
2. Оптическая изомерия характерна для молекул, которые не совпадают со своим зеркальным отображением. Таким свойством обладают любые молекулы, имеющие хотя бы один асимметрический (хиральный) центр – атом углерода, связанный с четырьмя различными заместителями. Например, оптические изомеры имеет молекула молочной кислоты СН3СН(ОН)СООН, в которой асимметрическим центром является центральный атом углерода:

Оптические изомеры имеют почти одинаковые физические и химические свойства.
