
- •Тема1. Теплообмінники.
- •Тема 2: масообмін Поняття масообміну, чим він викликається, аналогія до інших процесів переносу. Фазові стани в яких може відбуватись масообмін.
- •Аналогія між тепломасообміном
- •Дифузійний масообмін
- •Граничні умови
- •Аналогія з теплообміну
- •Дифузія газу у твердих тілах
- •Стаціонарний масообмін через плоску стіну
- •Конвективний масообмін
- •Критеріальні числа конвективного масообміну
- •Масоконвективні співвідношення
- •Теплові труби
- •Розрахунок теплової труби
- •Різниця тисків на викр. Поверхні
- •Залежність поверхневого натягу від температури
- •Ламінарна течія. Рівняння Пуазейля
- •Аксіальне число Re
- •Рівняння Нав’є Стокса
- •Перепад тиску в парофій фазі
Граничні умови
Зважаючи на аналогію між дифузійним мосообміном і теплопровідністю ми повинні зазначити граничні умови для визначення розподілу концентрації певного компоненту речовини.
Існує два види умов:
Граничні умови І роду, це коли задана визначальна концентрація компонента речовини.
Граничні умови ІІ роду визначальні потоки речовини.
Але попри існуючу аналогію є принципова відмінність між заданими температурами і концентраціями.
Температура є обов’язковою, безпосередньою функцією, а концентрація в загальному випадку також є.
Т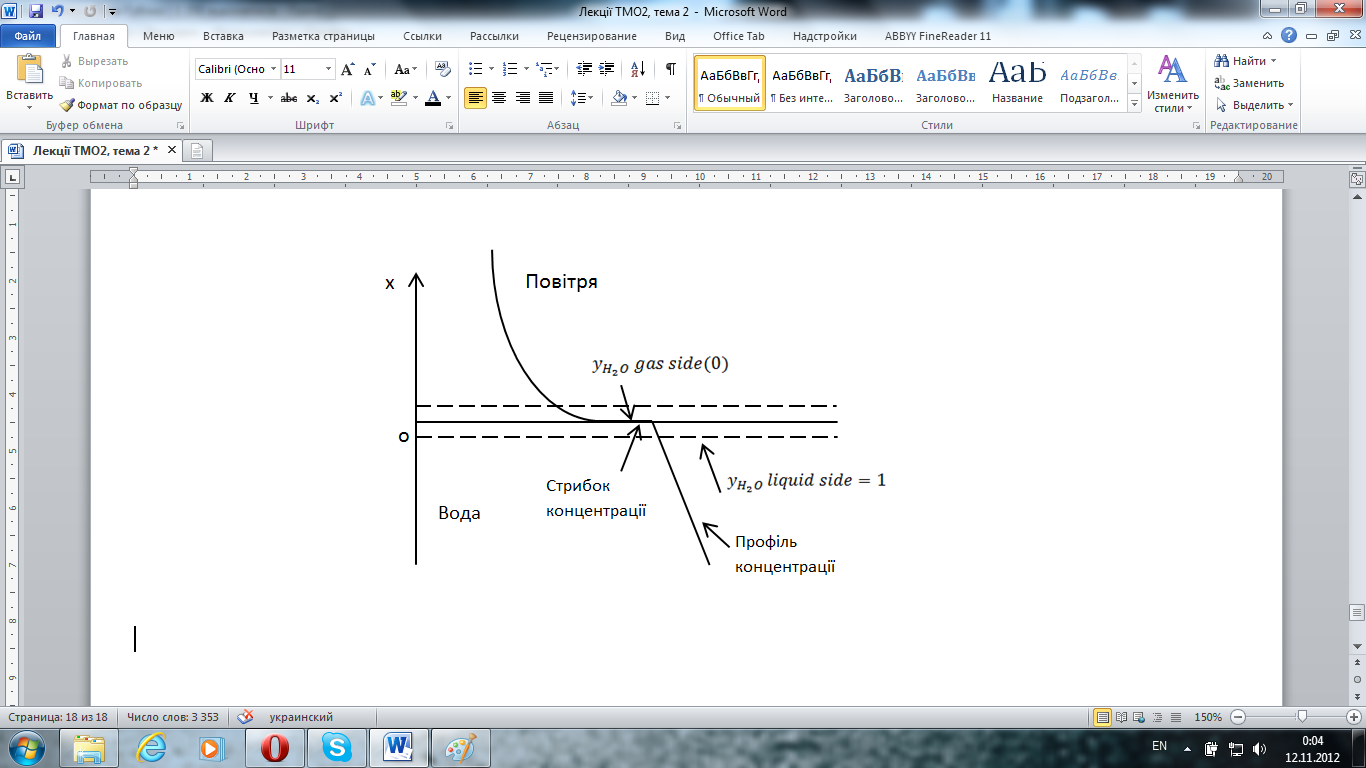 емпературні
стінки і температура повітря на поверхні
стінки завжди одна й та сама, а концентрація
повітря на обох сторонах міжфазної
поверхні вода-повітря дуже сильно
розрізняється.
емпературні
стінки і температура повітря на поверхні
стінки завжди одна й та сама, а концентрація
повітря на обох сторонах міжфазної
поверхні вода-повітря дуже сильно
розрізняється.
Концентрація води з обох боків міжфазної поверхні вода-повітря є суттєво різною, навіть з насиченим повітрям. Таким чином задаючи граничні умови шляхом визначення концентрації певного місця необхідно ще визначити з якої сторони границі ця концентрація має місце.
Використовуючи закон дифузії можна записати граничні умови ІІ роду.
Граничні
умови для дифузії компонента, а на
границі ![]() .
.
![]() густина
потоку;
густина
потоку;
![]() дифузійний потік;
дифузійний потік;
![]() - питомі
молярні і масові потоки компонента А
на міжфазній границі А=0.
- питомі
молярні і масові потоки компонента А
на міжфазній границі А=0.
Окремий випадок(спеціальний) коли ці потоки будуть нульовими, матиме місце якщо це поверхня є непроникна.
![]()
Аналогія з теплообміну
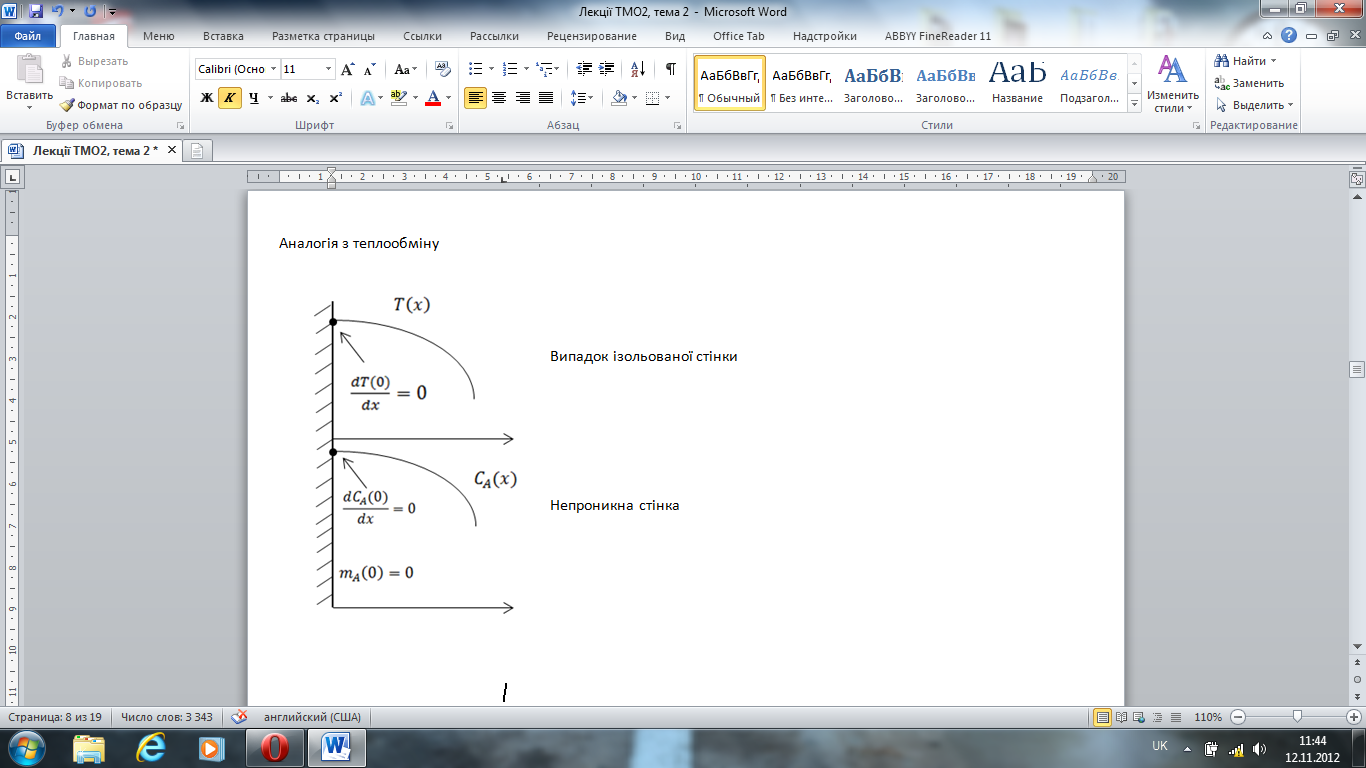
Звідки граничні умови у вигляді визначальної концентрації знаходяться з вимоги термодинамічної рівноваги на міжфазній поверхні для компонента міжфазної суміші.
Рідина-тверде тіло. При певній температурі, певна кількість твердого тіла може розчинятись у рідині і ця розчинна здатність визначається вимогою термодинамічної рівноваги між твердим тілом і розчином на міжфазній поверхні.
Розчинність в фактично максимальна, яка може розчинятись у даній рідині при даній температурі вона є кількісно визначена.
Розчинність натрій хлор у воді при температурі 310 К складає 36,5 кг на 100 кг води. Масова частка солі у цьому розчині на міжфазній поверхні складає
![]()
Зазначимо що у цьому процесі вода стає насиченою саме тоді коли 36,5 кг розчиниться при температурі 310К. У інших випадках цей розчин буде не насичений за цієї температури.
Міжфазна поверхня. Газ. Процес абсорбції, коли газ абсорбує з рідиною. Гази слабо розчиняються у рідинах і для таких розбавлених розчинів мольна фракція компонента і в газовій і в рідких фазах на міжфазній поверхні будуть пропорційні одна одній.
![]()
Фактично парціальний тиск з газової сторони буде пропорційний тиску всієї суміші компоненту суміші з рідиною сторони, якщо газ є ідеальним.
Відношення Генрі.
![]()
H – константа Генрі. Яка фактично є добутком загального тиску газової суміші і коефіцієнт пропорційності.
Константа Генрі для даного компонента є функцією лише температури і практично не залежить від тиску до величини атмосфери. З рівняння Генрі і константи Генрі можна зробити висновки.
Концентрація газу розчиненого у рідині зворотно пропорційна константі Генрі;
Зі зростанням температури, константі Генрі збільшується і відповідно частка зменшується;
Концентрація газу розчиненого у рідині пропорційна парціальному тиску від газу. Чим більший тиск, тим більша частка розчиненого газу;
Зазначимо що закон Генрі стосується розбавленого розчину газів у рідині. Тобто у рідині з маленькою кількістю розчинених в них газу.
Що робити якщо газ сильно розчиняється у воді чи в рідині? Наприклад алюміній плюс вода.
Лінійний закон Генрі з лінійною пропорційністю уже не працює і мала частка розчиненого газу визначається як формула температури і парціального тиску. Для мольної частки компонента і в рідині на газовій стороні міжфазної поверхні справедлива така формула.
![]()
![]() -тиск
насичення компонента і на міжфазній
поверхні компонента t;
-тиск
насичення компонента і на міжфазній
поверхні компонента t;
![]() -
загальний тиск (сумарний). Закон Рауля.
-
загальний тиск (сумарний). Закон Рауля.
