
- •Тема1. Теплообмінники.
- •Тема 2: масообмін Поняття масообміну, чим він викликається, аналогія до інших процесів переносу. Фазові стани в яких може відбуватись масообмін.
- •Аналогія між тепломасообміном
- •Дифузійний масообмін
- •Граничні умови
- •Аналогія з теплообміну
- •Дифузія газу у твердих тілах
- •Стаціонарний масообмін через плоску стіну
- •Конвективний масообмін
- •Критеріальні числа конвективного масообміну
- •Масоконвективні співвідношення
- •Теплові труби
- •Розрахунок теплової труби
- •Різниця тисків на викр. Поверхні
- •Залежність поверхневого натягу від температури
- •Ламінарна течія. Рівняння Пуазейля
- •Аксіальне число Re
- •Рівняння Нав’є Стокса
- •Перепад тиску в парофій фазі
Дифузійний масообмін
Дифузійний потік маси хімічні компоненти у суміші ( газова суміш, рідинна суміш, тверда речовина) пропорційна градієнту концентрацій цього компонента. Хоча концентрація зазвичай представляє собою кількість молекул на одиницю об’єму. Вона може визначатись декількома шляхами.
Масове визначення.
Концентрація
є густиною( масовою концентрацією ![]() парціальна
густина компонента і
парціальна
густина компонента і
![]()
![]()
![]()

Густина суміші у певному об’ємі дорівнює сумі густин її компонентів у цьому об’ємі.
Масова концентрація може бути виражена у безрозмірному вимірі через масову частку

Концентрація
в цій суміші ![]()
Масова частка змінюється від 0 до 1, і сума масових часток компоненти дорівнює 1.
Проте треба пам’ятати, що густина і масова частка компонентів в суміші загалом є змінною величиною, навіть якщо градієнт концентрації є нульовим.
Мольне визначення. За мольним визначенням концентрація представляє собою , виражається в молярній концентрації або молярна густина.
![]() ;
;
![]()
![]()
![]()
Парціальні,
мольні концентрації компонента ![]()
![]()
![]()
![]() –
молярна
частка ( 0÷1), сума дорівнює 1.
–
молярна
частка ( 0÷1), сума дорівнює 1.
Маса і кількість молів речовини пов’язані наступним чином
![]() для
питомого об’єму.
для
питомого об’єму.
![]()
![]()
![]()
З цих двох підходів кращий буде той який дає розв’язок проблеми у найбільш легкий спосіб. Спеціальний випадок: ідеальна газова суміш. При невисоких тисках газову суміш зручно апроксимувати як ідеальний газ.
Суміш повітря і водяної пари за атмосферного тиску можна розглядати як ідеальний газ похибкою менше 1 %.
![]() -
газовий тиск ;
-
газовий тиск ;
![]()
Парціальний
тиск компоненти ![]() це тиск який би мала ця компонента, якби
вона була єдиною в даному об’ємі (Закон
Дальтона).
це тиск який би мала ця компонента, якби
вона була єдиною в даному об’ємі (Закон
Дальтона).
![]()
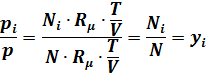
Закон дифузії Фіка:
Стаціонарна двокомпонентна речовина (1855 р.). Потік маси пропорційний градієнту концентрації для спокійної речовини. Де концентрація може бути виражена в різних варіантах.
Закон Фіка також буде мати декілька математичних форм запису. Запишемо закон Фіка для дифузії компонена А у стаціонарні бінарні суміші А+В в напрямку .
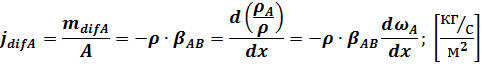
![]() -
густина потоку маси ;
-
густина потоку маси ;
Компонента А (масо передача шляхом дифузії в одиницю часу через одиницю площі в напрямку .

![]() – густина дифузійного молярного потоку.
– густина дифузійного молярного потоку.
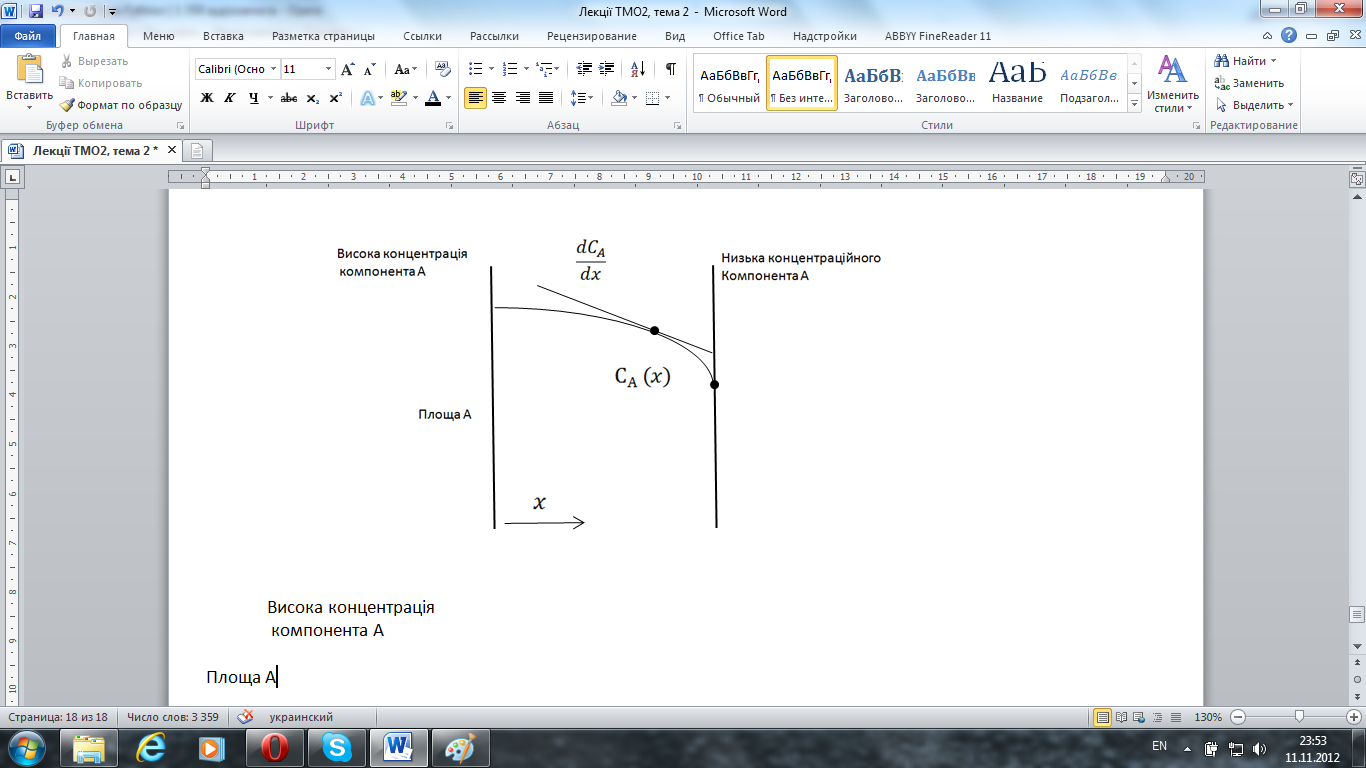
![]()
![]()
Проходження
в окремих випадках постійної густини
суміші ![]() і постійної молярної концентрації
закони
Фіка
виглядатимуть наступним чином.
і постійної молярної концентрації
закони
Фіка
виглядатимуть наступним чином.
![]() ;
;
![]()
Дифузійний потік маси

Повний масовий потік дифузії – концентрація на площу
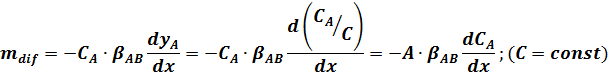
Постійна густина і постійна концентрація припускається у випадках твердих або розбавлених рідинних розчинах і цього загалом неможна припускати для газових сумішей і речовин рідини розчинів.
Для
більш складних випадків одноразовий
процес або багаторазовий дифузії закон
дифузії зручно записувати у векторній
формі записаним ![]() на
відповідний градієнт
на
відповідний градієнт
![]()
Аналогія з законом Фур’є
![]()
![]()
![]()
Коефіцієнт дифузії визначається експериментально.
Кінетична теорія газів дає наступні залежності для коефіцієнта дифузії
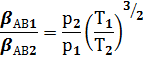
Коефіцієнт дифузії для газів незалежть від складу суміші і навпаки коефіцієнту дифузії для рідин, твердих розчинів виявляє сувору залежність від складу суміші.
Коефіцієнт дифузії є у газів і у твердих тілах, різниця декілька порядків.
Різко збільшується з температурою.
Для
розчину вуглецю у залізі від ![]() в
6000 разів зростає.
в
6000 разів зростає.
Дифузія, рушійною силою якої є градієнт концентрації – концентраційна дифузія. Проте дифузія може бути спричинена різними ефектами. Якщо у речовині наявна різниця температур він буде причиною дифузії , яка називається термодифузією (ефект Соре). Якщо наявна різниця тиску(градієнт тиску) то називатиметься бародифузією.
У загальному випадку ці дифузії є другорядними якими можна знехтувати . Але в спеціальних випадках вони можуть виходити на перший план. Якщо речовина розкручується в центрифузі утворює градієнт тиску спричиненою до центровою силою.
Причиною дифузії може бути дія зовнішніх масових сил – вимушені дифузії.
Якщо речовина є простою, і розмір менший за довжину пробігу молекули. Тоді молекулярне зіткнення відбувається дуже різко тим можна знехтувати і утворить вільна молекулярна довжина.
Кнуциївська дифузія. Якщо розмір пори співставляється з розміром молекули тоді молекули рухаються вздовж поверхні пори і така дифузія називається поверхневою.
Якщо
розмір частинок речовини знаходиться
на рівні 0,1 ![]() більша ніж молекулярний розмір, тоді
рух цих частинок під дією градієнта
концентрації називається Броунівським
рухом. Якщо розмір перевищує 1
більша ніж молекулярний розмір, тоді
рух цих частинок під дією градієнта
концентрації називається Броунівським
рухом. Якщо розмір перевищує 1 ![]() тоді ми не можемо , такий рух частинок
описується законом Ньютона.
тоді ми не можемо , такий рух частинок
описується законом Ньютона.
