
- •1. Основное содержание и цели термодинамики. Термодинамические параметры и функции состояния. Основные определения термодинамики. Термодинамический процесс.
- •2. Идеальный газ. Уравнение состояния. Закон Дальтона. Реальные газы.
- •3. Внутренняя энергия и энтальпия. Первый закон термодинамики.
- •1 Закон термодинамики
- •4. Теплоемкость. Зависимость теплоемкости от температуры.
- •5. Стандартное состояние вещества. Стандартная теплота образования.
- •6. Тепловой эффект химической реакции. Закон Гесса.
- •7. Второй закон термодинамики. Энтропия.
- •8. Энергия Гиббса, стандартная энергия Гиббса. Понятие о химическом потенциале.
- •9. Химическое равновесие. Условия равновесия. Константа равновесия, и ее зависимость от температуры. Примеры записи константы равновесия для реакций с участием газовой и конденсированных фаз.
- •10. Уравнение изотермы химической реакции. Определение направления химической реакции.
- •11.Принцип смещения равновесий. Примеры его использования.
- •12. Оценка состава и свойств газовой атмосферы со – со2 –о2. Условие окисления металла в газовой атмосфере, диссоциации оксида металла.
- •13. Правило фаз Гиббса. Его использование.
- •14. Фазовые превращения 1-го и 2-го рода. Насыщенный пар, упругость пара и ее зависимость от температуры, теплота превращений.
- •15. Фазовые однокомпонентные диаграммы. Уравнение Клапейрона-Клаузиуса.
- •16. Фазовые диаграммы двухкомпонентных систем: компоненты а и в …… (3 фрагмента).
- •18. Растворы. Идеальные растворы. Законы Рауля и Генри. Термодинамическая активность.
- •19. Термодинамические параметры взаимодействия, их использование в расчетах.
- •20. Активность и коэффициент активности компонента металлического раствора и их расчет.
- •21. Кинетика и ее задачи. Кинетическое уравнение. Константа скорости и ее зависимость от температуры (уравнение Аррениуса), порядок реакции, энергия активации и их определение.
- •22. Гетерогенные процессы. Диффузионная и кинетическая области реагирования. Лимитирующая стадия.
- •23. Концентрационный кислородный гальванический элемент с твердым электролитом. Его устройство, принцип работы. Схема измерения эдс. Температурные пределы использования кислородных датчиков.
- •24. Уравнение Нернста. Его получение и использование в расчетах.
- •25. Учет в расчетах электронной проводимости твердых электролитов.
- •26. Электроды сравнения в кислородных датчиках и определение равновесного парциального
- •27. Расчет активности кислорода в металлическом расплаве по результатам эл.Хим.Измерений.
- •29. Поверхностно активные вещества. Пав в расплаве железа, их влияние на поверхностное натяжение, краевой угол смачивания .
19. Термодинамические параметры взаимодействия, их использование в расчетах.
П роизводные
уравнения называются массовыми
параметрами взаимодействия первого и
второго порядков и обозначаются
соответственно
роизводные
уравнения называются массовыми
параметрами взаимодействия первого и
второго порядков и обозначаются
соответственно

- массовый параметр взаимодействия компонента i с компонентом j первого порядка.

- массовый параметр взаимодействия компонента i с компонентом
j второго порядка
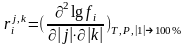
-массовый перекрестный параметр взаимодействия компонента i
второго порядка.

О бычно
температурная зависимость параметров
взаимодействия имеет вид
бычно
температурная зависимость параметров
взаимодействия имеет вид
А и В – компоненты, Т – температура, К.
20. Активность и коэффициент активности компонента металлического раствора и их расчет.
Под активностью компонента в растворе понимают отношение парциального давления пара компонента над раствором к давлению пара этого же вещества, находящегося в стандартном состоянии
А
 ктивность
имеет тот же физический смысл, что и
концентрация, но учитывает взаимодействие
частиц в растворе
ктивность
имеет тот же физический смысл, что и
концентрация, но учитывает взаимодействие
частиц в растворе

Коэффициент активности количественно характеризует отличие реального раствора от идеального
при определенной концентрации.
Для описания отклонений реальных растворов от закона Генри служит коэффициент активности

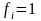
 -
-в области идеального разбавленного
раствора
-
-в области идеального разбавленного
раствора
 -
При положительных
отклонениях
от закона Генри
-
При положительных
отклонениях
от закона Генри
- При отрицательных отклонениях

- концентрация i-го компонента металлического расплава, % масс.
21. Кинетика и ее задачи. Кинетическое уравнение. Константа скорости и ее зависимость от температуры (уравнение Аррениуса), порядок реакции, энергия активации и их определение.
Химическая кинетика – наука, изучающая количественные закономерности химических процессов, протекающих во времени
Основной закон формальной кинетики: скорость реакции в прямом направлении пропорциональна концентрациям реагирующих веществ
Задачи:
-нахождение математического описания зависимости скорости от параметра (Т,С).Найти кинетическое уравнение.
-установление механизма процесса и нахождение кинетических констант
Уравнения, выражающие связь между скоростью реакции и концентрациями,
называются кинетическими
Уравнение
Аррениуса:



К-константа скорости. (коэффициент пропорциональности в кинетическом уравнении, связывающем скорость реакции с концентрациями реагирующих веществ и их стехиометрическими коэффициентами)
Порядок реакции (n) – сумма показателей, с которыми концентрации входят в кинетическое уравнение.
Нулевой порядок. (Скорость реакции постоянна и не зависит от времени).



Первый порядок. (Скорость пропорциональна концентрации впервой степени



Второй порядок скорость пропорциональна концентрации во второй степени


Е – энергия активации процесса (кажущаяся), представляет собой разность между средней энергией реагирующих частиц и средней энергией всех частиц, участвующих в соударениях.
