
- •1. Основное содержание и цели термодинамики. Термодинамические параметры и функции состояния. Основные определения термодинамики. Термодинамический процесс.
- •2. Идеальный газ. Уравнение состояния. Закон Дальтона. Реальные газы.
- •3. Внутренняя энергия и энтальпия. Первый закон термодинамики.
- •1 Закон термодинамики
- •4. Теплоемкость. Зависимость теплоемкости от температуры.
- •5. Стандартное состояние вещества. Стандартная теплота образования.
- •6. Тепловой эффект химической реакции. Закон Гесса.
- •7. Второй закон термодинамики. Энтропия.
- •8. Энергия Гиббса, стандартная энергия Гиббса. Понятие о химическом потенциале.
- •9. Химическое равновесие. Условия равновесия. Константа равновесия, и ее зависимость от температуры. Примеры записи константы равновесия для реакций с участием газовой и конденсированных фаз.
- •10. Уравнение изотермы химической реакции. Определение направления химической реакции.
- •11.Принцип смещения равновесий. Примеры его использования.
- •12. Оценка состава и свойств газовой атмосферы со – со2 –о2. Условие окисления металла в газовой атмосфере, диссоциации оксида металла.
- •13. Правило фаз Гиббса. Его использование.
- •14. Фазовые превращения 1-го и 2-го рода. Насыщенный пар, упругость пара и ее зависимость от температуры, теплота превращений.
- •15. Фазовые однокомпонентные диаграммы. Уравнение Клапейрона-Клаузиуса.
- •16. Фазовые диаграммы двухкомпонентных систем: компоненты а и в …… (3 фрагмента).
- •18. Растворы. Идеальные растворы. Законы Рауля и Генри. Термодинамическая активность.
- •19. Термодинамические параметры взаимодействия, их использование в расчетах.
- •20. Активность и коэффициент активности компонента металлического раствора и их расчет.
- •21. Кинетика и ее задачи. Кинетическое уравнение. Константа скорости и ее зависимость от температуры (уравнение Аррениуса), порядок реакции, энергия активации и их определение.
- •22. Гетерогенные процессы. Диффузионная и кинетическая области реагирования. Лимитирующая стадия.
- •23. Концентрационный кислородный гальванический элемент с твердым электролитом. Его устройство, принцип работы. Схема измерения эдс. Температурные пределы использования кислородных датчиков.
- •24. Уравнение Нернста. Его получение и использование в расчетах.
- •25. Учет в расчетах электронной проводимости твердых электролитов.
- •26. Электроды сравнения в кислородных датчиках и определение равновесного парциального
- •27. Расчет активности кислорода в металлическом расплаве по результатам эл.Хим.Измерений.
- •29. Поверхностно активные вещества. Пав в расплаве железа, их влияние на поверхностное натяжение, краевой угол смачивания .
13. Правило фаз Гиббса. Его использование.
При рассмотрении систем со многими компонентами необходимо знать
число фаз, существующих при равновесии, и изменение числа фаз при изменении одного из параметров системы.
Правило фаз представляет уравнение:
С = К + n – f
C – число степеней свободы;
К – число компонентов;
n – параметры системы;
f – число фаз.
Число компонентов К – число индивидуальных веществ, входящих в систему, за вычетом числа химических уравнений, связывающих эти вещества.
Число степеней свободы С – это число параметров(T, P, концентрации), которые полностью определяют состояние системы при равновесии и которые можно менять в определенных пределах без изменения числа и природы фаз.
Часто n=2 (T, P). Если рассматриваются системы с конденсированными фазами, где давление часто не оказывает влияние на состояние системы, правило фаз принимает вид.
С = К + 1 – f
Число степеней свободы не может быть меньше нуля.
Правило фаз используют при рассмотрении диаграмм состояний и применят для анализа систем, в которых проходят химические превращения.
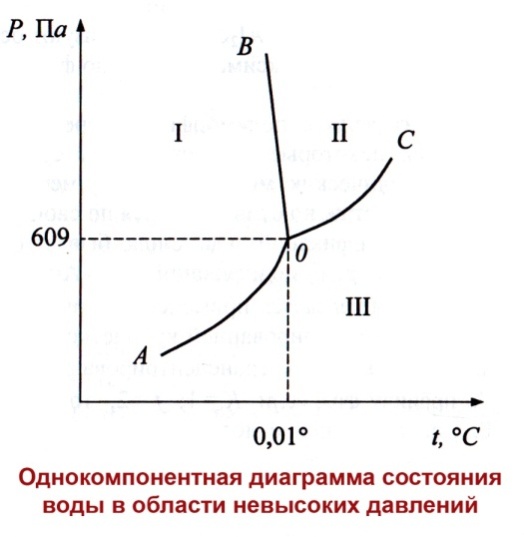
В соответствии с правилами фаз Гиббса для однокомпонентной системы
с=1+2-f
При наличии одной фазы с=2 – система бивариантна, если в равновесии две фазы, то с=1 (моновариантна), если в равновесии находятся три фазы с=0 (система нонвариантна).
14. Фазовые превращения 1-го и 2-го рода. Насыщенный пар, упругость пара и ее зависимость от температуры, теплота превращений.
Процессы перехода вещества из одной фазы в другую, не сопровождающиеся химическими реакциями, называются фазовыми превращениями.
К фазовым превращениям относятся:
• Плавление
• Кристаллизация
• Испарение и конденсация
• Возгонка
• Изменение кристаллической модификации и магнитного состояния
Фазовые превращения, сопровождающиеся выделением или поглощением теплоты, которые называются скрытой теплотой превращения, относят к фазовым переходам первого рода.
Переход вещества из одной кристаллической модификации в другую, когда нет выделения или поглощения тепла, относят к фазовым переходам второго рода.
Пар, находящийся в равновесии со своей жидкостью, называется насыщенным.
Давление, при котором существует равновесие, называется давлением (упругостью) насыщенного пара. Важнейшей характеристикой является точка кипения вещества - температура, при которой давление насыщенного пара становится равным одной атмосфере. Пар, при определенном давлении, имеющий по сравнению с насыщенным паром более высокую температуру, называется перегретым паром, более низкую – пересыщенным паром.
Кривая, изображающая температуру кипения в зависимости от давления, является одновременно и кривой упругости пара в зависимости от температуры.
Цифры, нанесенные на график температуры кипения (или на график упругости пара), показывают, что упругость пара меняется очень резко с изменением температуры. При 0°С (т. е. 273 К) упругость пара равна 4,6 мм рт. ст., при 100°С (373 К) она равна 760 мм рт. ст., т. е. возрастает в 165 раз. При повышении температуры вдвое (от 0°С, т. е. 273 К, до 273°С, т. е. 546 К) упругость пара возрастает с 4,6 мм рт. ст. почти до 60 атм, т. е. примерно в 10 000 раз.
Поэтому, напротив, температура кипения меняется с давлением довольно медленно. При изменении давления вдвое от 0,5 атм до 1 атм температура кипения возрастает от 82°С (355 К) до 100°С (373 К) и при изменении вдвое от 1 до 2 атм - от 100°С (373 К) до 120°С (393 К).
