
- •1. Основное содержание и цели термодинамики. Термодинамические параметры и функции состояния. Основные определения термодинамики. Термодинамический процесс.
- •2. Идеальный газ. Уравнение состояния. Закон Дальтона. Реальные газы.
- •3. Внутренняя энергия и энтальпия. Первый закон термодинамики.
- •1 Закон термодинамики
- •4. Теплоемкость. Зависимость теплоемкости от температуры.
- •5. Стандартное состояние вещества. Стандартная теплота образования.
- •6. Тепловой эффект химической реакции. Закон Гесса.
- •7. Второй закон термодинамики. Энтропия.
- •8. Энергия Гиббса, стандартная энергия Гиббса. Понятие о химическом потенциале.
- •9. Химическое равновесие. Условия равновесия. Константа равновесия, и ее зависимость от температуры. Примеры записи константы равновесия для реакций с участием газовой и конденсированных фаз.
- •10. Уравнение изотермы химической реакции. Определение направления химической реакции.
- •11.Принцип смещения равновесий. Примеры его использования.
- •12. Оценка состава и свойств газовой атмосферы со – со2 –о2. Условие окисления металла в газовой атмосфере, диссоциации оксида металла.
- •13. Правило фаз Гиббса. Его использование.
- •14. Фазовые превращения 1-го и 2-го рода. Насыщенный пар, упругость пара и ее зависимость от температуры, теплота превращений.
- •15. Фазовые однокомпонентные диаграммы. Уравнение Клапейрона-Клаузиуса.
- •16. Фазовые диаграммы двухкомпонентных систем: компоненты а и в …… (3 фрагмента).
- •18. Растворы. Идеальные растворы. Законы Рауля и Генри. Термодинамическая активность.
- •19. Термодинамические параметры взаимодействия, их использование в расчетах.
- •20. Активность и коэффициент активности компонента металлического раствора и их расчет.
- •21. Кинетика и ее задачи. Кинетическое уравнение. Константа скорости и ее зависимость от температуры (уравнение Аррениуса), порядок реакции, энергия активации и их определение.
- •22. Гетерогенные процессы. Диффузионная и кинетическая области реагирования. Лимитирующая стадия.
- •23. Концентрационный кислородный гальванический элемент с твердым электролитом. Его устройство, принцип работы. Схема измерения эдс. Температурные пределы использования кислородных датчиков.
- •24. Уравнение Нернста. Его получение и использование в расчетах.
- •25. Учет в расчетах электронной проводимости твердых электролитов.
- •26. Электроды сравнения в кислородных датчиках и определение равновесного парциального
- •27. Расчет активности кислорода в металлическом расплаве по результатам эл.Хим.Измерений.
- •29. Поверхностно активные вещества. Пав в расплаве железа, их влияние на поверхностное натяжение, краевой угол смачивания .
10. Уравнение изотермы химической реакции. Определение направления химической реакции.
Для реакции, протекающей в изобарно-изотермических условиях, в некотором неравновесном исходном состоянии энергии Гиббса или химические потенциалы реагирующих веществ и продуктов реакции в общем случае не одинаковы, их разность (ΔGT) может быть рассчитана по уравнению:
![]() где
где
![]() ,
,
![]() ,
,
![]() парциальные давления
парциальные давления
компонентов в исходной газовой смеси.
Это уравнение называют уравнением изотермы химической реакции. Оно позволяет рассчитать изменение энергии Гиббса при протекании процесса и определить направление протекания реакции:
при
![]() —
реакция идёт в прямом направлении, слева
направо;
—
реакция идёт в прямом направлении, слева
направо;
при ![]() —
реакция достигла равновесного состояния;
—
реакция достигла равновесного состояния;
при ![]() —
реакция идёт в обратном направлении.
—
реакция идёт в обратном направлении.
11.Принцип смещения равновесий. Примеры его использования.
Химическим равновесием называется такое состояние химической системы, при котором количества исходных веществ и продуктов не меняются со временем.
Принципом смещения равновесия называют принцип Ле-Шателье.
Формулировка: Равновесие смещается в направлении, обратном оказанному на систему внешнему воздействию.
Применяя принцип Ле Шателье, можно качественно определить влияние температуры и давления на положение равновесия и предсказать, какие условия будут способствовать протеканию процесса в желаемом направлении. Если в процессе образуется большее число газообразных молей веществ, чем вступает в реакцию, то для смещения равновесия вправо необходимо понижать давление в системе. Если процесс идет с уменьшением числа молей газообразных компонентов, то чтобы повысить его эффективность, нужно повысить давление в системе.
Пример использования принципа:
Реакция 2SO2 + O2 2SO3 (г) экзотермична. Если повысить температуру, преимущество получит эндотермическая реакция разложения SО3 и равновесие сместится влево. Если же понизить температуру, равновесие сместится вправо. Так, смесь SО2 и О2, взятых в стехиометрическом соотношении 2: 1 (, при температуре 400° С и атмосферном давлении превращается в SО3 с выходом около 95%, т.е. состояние равновесия в этих условиях почти полностью смещено в сторону SО3. При 600° С равновесная смесь содержит уже 76% SО3, а при 800° С - только 25%. Именно поэтому при сжигании серы на воздухе образуется в основном SО2 и лишь около 4% SО3. Из уравнения реакции следует также, что повышение общего давления в системе будет сдвигать равновесие вправо, а при понижении давления равновесие будет смещаться влево.
12. Оценка состава и свойств газовой атмосферы со – со2 –о2. Условие окисления металла в газовой атмосфере, диссоциации оксида металла.
Газовая атмосфера может быть окислительной, восстановительной, нейтральной по отношению к металлам и соединениям, способной науглероживать, азотировать и обезуглероживать металл.
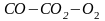
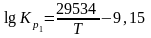
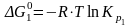
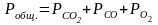
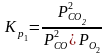
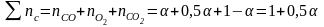
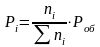
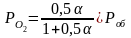
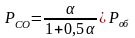



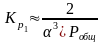
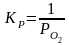

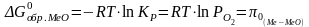
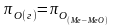 -газовая
фаза, металл и оксид металла находятся
в равновесии.
-газовая
фаза, металл и оксид металла находятся
в равновесии.
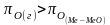 -происходит
окисление металла и образование оксида
-происходит
окисление металла и образование оксида
 -кислород
из системы Ме – МеО должен переходить
в газовую фазу, то есть должно
происходить выделение металла.
-кислород
из системы Ме – МеО должен переходить
в газовую фазу, то есть должно
происходить выделение металла.
