
- •1. Основное содержание и цели термодинамики. Термодинамические параметры и функции состояния. Основные определения термодинамики. Термодинамический процесс.
- •2. Идеальный газ. Уравнение состояния. Закон Дальтона. Реальные газы.
- •3. Внутренняя энергия и энтальпия. Первый закон термодинамики.
- •1 Закон термодинамики
- •4. Теплоемкость. Зависимость теплоемкости от температуры.
- •5. Стандартное состояние вещества. Стандартная теплота образования.
- •6. Тепловой эффект химической реакции. Закон Гесса.
- •7. Второй закон термодинамики. Энтропия.
- •8. Энергия Гиббса, стандартная энергия Гиббса. Понятие о химическом потенциале.
- •9. Химическое равновесие. Условия равновесия. Константа равновесия, и ее зависимость от температуры. Примеры записи константы равновесия для реакций с участием газовой и конденсированных фаз.
- •10. Уравнение изотермы химической реакции. Определение направления химической реакции.
- •11.Принцип смещения равновесий. Примеры его использования.
- •12. Оценка состава и свойств газовой атмосферы со – со2 –о2. Условие окисления металла в газовой атмосфере, диссоциации оксида металла.
- •13. Правило фаз Гиббса. Его использование.
- •14. Фазовые превращения 1-го и 2-го рода. Насыщенный пар, упругость пара и ее зависимость от температуры, теплота превращений.
- •15. Фазовые однокомпонентные диаграммы. Уравнение Клапейрона-Клаузиуса.
- •16. Фазовые диаграммы двухкомпонентных систем: компоненты а и в …… (3 фрагмента).
- •18. Растворы. Идеальные растворы. Законы Рауля и Генри. Термодинамическая активность.
- •19. Термодинамические параметры взаимодействия, их использование в расчетах.
- •20. Активность и коэффициент активности компонента металлического раствора и их расчет.
- •21. Кинетика и ее задачи. Кинетическое уравнение. Константа скорости и ее зависимость от температуры (уравнение Аррениуса), порядок реакции, энергия активации и их определение.
- •22. Гетерогенные процессы. Диффузионная и кинетическая области реагирования. Лимитирующая стадия.
- •23. Концентрационный кислородный гальванический элемент с твердым электролитом. Его устройство, принцип работы. Схема измерения эдс. Температурные пределы использования кислородных датчиков.
- •24. Уравнение Нернста. Его получение и использование в расчетах.
- •25. Учет в расчетах электронной проводимости твердых электролитов.
- •26. Электроды сравнения в кислородных датчиках и определение равновесного парциального
- •27. Расчет активности кислорода в металлическом расплаве по результатам эл.Хим.Измерений.
- •29. Поверхностно активные вещества. Пав в расплаве железа, их влияние на поверхностное натяжение, краевой угол смачивания .
7. Второй закон термодинамики. Энтропия.
Существуют разные формулировки второго закона термодинамики.
1.Теплота не может самопроизвольно переходить от более холодного тела к более нагретому.
2.«Вечный двигатель 2-го рода» невозможен. (под вечным двигателем второго рода
Понимается машина, которая могла бы превращать всю подводимую к ней теплоту
в работу. Такая машина имела бы КПД равным 1).
3.В изолированных системах самопроизвольно идут процессы только с возрастанием
энтропии и до такого состояния, при котором энтропия максимальна для данных условий.
Энтропия - часть внутренней энергии замкнутой системы, которая постоянно сохраняется и не превращается в другие виды энергии.
8. Энергия Гиббса, стандартная энергия Гиббса. Понятие о химическом потенциале.
Свободная энергия Гиббса (или просто энергия Гиббса,— это величина, показывающая изменение энергии в ходе химической реакции и дающая таким образом ответ на вопрос о принципиальной возможности протекания химической реакции; это термодинамический потенциал следующего вида:
![]() где
где ![]() — внутренняя
энергия
,
— внутренняя
энергия
, ![]() — давление,
— давление, ![]() — объём,
— объём, ![]() —
абсолютная температура,
—
абсолютная температура, ![]() — энтропия.
— энтропия.
Под стандартной энергией Гиббса образования ΔG°, понимают изменение энергии Гиббса при реакции образования 1 моль вещества, находящегося в стандартном состоянии. Это определение подразумевает, что стандартная энергия Гиббса образования простого вещества, устойчивого в стандартных условиях, равна нулю.
Химический потенциал вещества (компонента) в системе - есть изменение энергии Гиббса системы при увеличении в ней на один моль количества данного вещества, при неизменности Р, Т, постоянстве количества всех остальных компонентов (веществ).
9. Химическое равновесие. Условия равновесия. Константа равновесия, и ее зависимость от температуры. Примеры записи константы равновесия для реакций с участием газовой и конденсированных фаз.
Химическое равновесие – состояние химической системы, при котором возможны реакции, идущие с равными скоростями в противоположных направлениях. При химическом равновесии концентрации реагентов, температура и другие параметры системы не изменяются со временем.
Условия:
1.Неизменность равновесного состояния системы при сохранении внешних условий.
2. Устойчивость равновесия.
3. Динамический характер равновесия.
Константа равновесия:
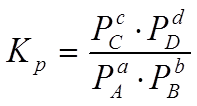
Константа равновесия – есть отношение произведений парциальных давлений продуктов реакции к произведению парциальных давлений исходных веществ, взятых в степенях, равных стехиометрическим коэффициентам реакции.
Зависимость константы равновесия от температуры:
Уравнение, связывающее изменении Кр с температурой при Р=const носит название изобары химической реакции.
![]()
Уравнение показывает, что знак производной определяется знаком теплового эффекта реакции. Если производная положительна, то функция ln Kp является возрастающей.
Таким образом:
Для эндотермических реакций, для которых ΔH>0, Kp возрастает с ростом температуры.
Для экзотермических реакций, для которых ΔH<0, Kp уменьшается с ростом температуры.
В тех случаях, когда тепловой эффект реакции очень мал (близок к нулю), Кр не зависит от температуры.
