
- •1. Основное содержание и цели термодинамики. Термодинамические параметры и функции состояния. Основные определения термодинамики. Термодинамический процесс.
- •2. Идеальный газ. Уравнение состояния. Закон Дальтона. Реальные газы.
- •3. Внутренняя энергия и энтальпия. Первый закон термодинамики.
- •1 Закон термодинамики
- •4. Теплоемкость. Зависимость теплоемкости от температуры.
- •5. Стандартное состояние вещества. Стандартная теплота образования.
- •6. Тепловой эффект химической реакции. Закон Гесса.
- •7. Второй закон термодинамики. Энтропия.
- •8. Энергия Гиббса, стандартная энергия Гиббса. Понятие о химическом потенциале.
- •9. Химическое равновесие. Условия равновесия. Константа равновесия, и ее зависимость от температуры. Примеры записи константы равновесия для реакций с участием газовой и конденсированных фаз.
- •10. Уравнение изотермы химической реакции. Определение направления химической реакции.
- •11.Принцип смещения равновесий. Примеры его использования.
- •12. Оценка состава и свойств газовой атмосферы со – со2 –о2. Условие окисления металла в газовой атмосфере, диссоциации оксида металла.
- •13. Правило фаз Гиббса. Его использование.
- •14. Фазовые превращения 1-го и 2-го рода. Насыщенный пар, упругость пара и ее зависимость от температуры, теплота превращений.
- •15. Фазовые однокомпонентные диаграммы. Уравнение Клапейрона-Клаузиуса.
- •16. Фазовые диаграммы двухкомпонентных систем: компоненты а и в …… (3 фрагмента).
- •18. Растворы. Идеальные растворы. Законы Рауля и Генри. Термодинамическая активность.
- •19. Термодинамические параметры взаимодействия, их использование в расчетах.
- •20. Активность и коэффициент активности компонента металлического раствора и их расчет.
- •21. Кинетика и ее задачи. Кинетическое уравнение. Константа скорости и ее зависимость от температуры (уравнение Аррениуса), порядок реакции, энергия активации и их определение.
- •22. Гетерогенные процессы. Диффузионная и кинетическая области реагирования. Лимитирующая стадия.
- •23. Концентрационный кислородный гальванический элемент с твердым электролитом. Его устройство, принцип работы. Схема измерения эдс. Температурные пределы использования кислородных датчиков.
- •24. Уравнение Нернста. Его получение и использование в расчетах.
- •25. Учет в расчетах электронной проводимости твердых электролитов.
- •26. Электроды сравнения в кислородных датчиках и определение равновесного парциального
- •27. Расчет активности кислорода в металлическом расплаве по результатам эл.Хим.Измерений.
- •29. Поверхностно активные вещества. Пав в расплаве железа, их влияние на поверхностное натяжение, краевой угол смачивания .
1. Основное содержание и цели термодинамики. Термодинамические параметры и функции состояния. Основные определения термодинамики. Термодинамический процесс.
Термодинамика - наука о превращении тепла в работу.
а) общая – Рассматривает фундаментальные основы науки и их применение к физическим явлениям
б) техническая – Рассматривает основные законы в применении к взаимопревращению теплоты и работы
в) химическая - Позволяет применять законы классической термодинамики к химическим и физико-химическим процессам
Термодинамические параметры:
а) экстенсивные - зависят от общего количества вещества в системе (объем, масса, число молей компонентов и др.)
б) интенсивные - не зависят от количества вещества в системе (температура, давление, мольная доля).
Функция состояния в термодинамике — функция независимых параметров, определяющих равновесное состояние термодинамической системы; не зависит от пути (характера процесса), следуя которому система пришла в рассматриваемое равновесное состояние (т.е. не зависит от предыстории системы); к функциям состояния относят, в частности, характеристические функции системы:
1)внутренняя энергия;
2)энтропия;
3)энтальпия и др.
Основные определения:
Система – совокупность тел, фактически или мысленно выделяемых из окружающей среды.
Изолированная система - не может обмениваться с окружающей средой ни энергией, ни веществом и имеет постоянный объем и энергию.
Открытая система – находится в состоянии обмена с окружающей средой по массе и по энергии. Она не имеет постоянного объема.
Компонент – химически индивидуальное вещество, которое может быть выделено из системы и существовать самостоятельно.
Параметры состояния системы - параметры, которые выбирают в качестве независимых переменных и которые определяют состояние системы.
Термодинамический процесс – есть переход системы из одного состояния равновесия в другое. Этому соответствует изменение одного или нескольких параметров системы.
2. Идеальный газ. Уравнение состояния. Закон Дальтона. Реальные газы.
Идеальный газ – газ, молекулы которого рассматриваются как невзаимодействующие друг с другом материальные точки.
Модель идеального газа:
1.Молекулы (атомы) принимаются за материальные точки с определенной массой. Размеры их ничтожны по сравнению с расстоянием между ними.
2.Молекулы (атомы) находятся в состоянии непрерывного и постоянного движения.
Между столкновениями они движутся прямолинейно. Движения равновероятны по всем направлениям.
3.Скорости частиц могут быть любыми.
4.При столкновении молекулы (атомы) ведут себя как упругие шары. Между частицами не действуют силы притяжения или отталкивания
Уравнение состояния (иногда уравнение Клапейрона или уравнение Менделеева — Клапейрона) — формула, устанавливающая зависимость между давлением, молярным объёмом и абсолютной температурой идеального газа. Уравнение имеет вид:
![]()
где
 — давление,
— давление,
 — молярный
объём,
— молярный
объём,
 — универсальная
газовая постоянная
— универсальная
газовая постоянная
 — абсолютная
температура,
К.
— абсолютная
температура,
К.
Уравнения идеального газа
![]()
![]()
![]()
![]()
![]()
![]()
Реальные газы
При повышении плотности изменяются свойства газов – они перестают быть идеальными. Простейшим уравнением, которое качественно правильно описывает отличие реального газа от идеального, является уравнение Ван-дер-Ваальса
![]()
Закон Дальтона
Общее давление смеси идеальных газов равно сумме парциальных давлений компонентов.
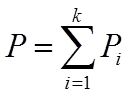
![]() ,
Xi-молярная доля i-го компонента в смеси.
,
Xi-молярная доля i-го компонента в смеси.
