
- •«Поволжский государственный университет телекоммуникаций и информатики» химия
- •Содержание
- •Введение
- •Список рекомендуемой литературы Основная
- •8. Ахметов н.С. Общая и неорганическая химия. -м.: Высшая школа. 1987. Варианты контрольных заданий
- •Задачи по химии
- •Методические указания к выполнению контрольной работы
- •1. Простейшие стехиометрические расчеты
- •1.1.Эквивалент. Закон эквивалентов.
- •5,6 Г железа эквивалентны 3,2 г серы,
- •28 Г металла эквивалентны 11,2 л водорода
- •2. Основные газовые законы.
- •3. Моль. Закон авогадро. Мольный объем газа
- •28 Г азота занимают объем 22,4 л ,
- •Задачи 4-6
- •4.Определение молекулярных масс веществ в газообразном состоянии
- •0, 824 Г газа занимают объем 0,260 л ,
- •Задачи 7-9
- •Вывод химических формул. Расчеты по химическим уравнениям
- •117 Г NaCl дают 22,4 л Сl , 100 г NaCl - X л Cl
- •Задачи 10-12
- •6.Основные классы неорганических соединений
- •Задачи 13-15
- •7. Строение атома. Электронная структура атомов. Зависимость свойств элементов от строения их атомов
- •Задачи 16-18
- •8. Химическая связь. Типы химической связи
- •Задачи 19-21
- •9. Полярность молекул. Геометрическая структура молекул
- •Задачи 22-23
- •10. Ионная связь. Поляризация ионов
- •Задачи 24-26
- •11. Водородная связь. Межмолекулярное взаимодействие
- •Задачи 26-27
- •12.Основные закономерности протекания химических реакций
- •12.1. Энергетика химических реакций.
- •Задачи 27-30
- •12.2. Скорость химических реакций. Химическое равновесие
- •Задачи 31-36
- •13. Растворы
- •13.1 Способы выражения содержания растворенного вещества в растворе. Растворимость
- •Задачи 37-42
- •13.2 Физико-химические свойства разбавленных растворов неэлектролитов
- •Задачи 43-45
- •14. Растворы электролитов
- •14.1. Слабые электролиты. Константа и степень диссоциации
- •Задачи 46-47
- •14.2. Сильные электролиты. Активность ионов
- •Задачи 48-49
- •14.3. Ионнное произведение воды. Водородный показатель
- •Задачи 50-52
- •15. Обменные реакции в растворах электролитов. Гидролиз воды
- •Задачи 53-55
- •16. Окислительно-восстановительные реакции. Основы электрохимии
- •16.1 . Степень окисленности. Окисление и восстановление.
- •Задачи 56-58
- •16.2. Окислители и восстановители
- •Окислители
- •Восстановители
- •Задачи 59-60
- •16.3. Составление уравнений окислительно-восстановительных реакций
- •Задачи 61-63
- •17. Химические источники электрической энергии. Электродные потенциалы
- •Задачи 64-66
- •Ответы к задачам контрольного задания
Задачи по химии
1. При сгорании 5 г металла образуется 9,44 г оксида металла. Определить эквивалентную массу металла.
2. Одно и то же количество металла соединяется с 0,2 г кислорода и с 3,17 г одного из галогенов. Определить эквивалентную массу галогена.
3. Масса 1 л кислорода равна 1,4 г. Сколько литров кислорода рас-ходуется при сгорании 21 г магния, эквивалент которого равен 1/2 моля?
4. Определить эквивалентные массы металла и серы, если 3,24 г металла образует 3,48 г оксида и 3,72 г сульфида.
5. Вычислить атомную массу двухвалентного металла и опре-делить, какой это металл, если 8,34 г металла окисляются 0,68 л кислорода (условия нормальные).
6. Мышьяк образует 2 оксида, из которых один содержит 65,2% (масс.), а другой 75,7% (массовых) мышьяка. Определить эквивалент-ные массы мышьяка в обоих случаях.
7. Металл в количестве 1 г соединяется с 8,89 г брома и с 1,78 г серы. Найти эквивалентные массы металла и брома, зная, что эквивалентная масса серы равна 16 г/моль.
8. Эквивалентная масса хлора равна 35,5 г/моль. Эквивалентная масса хлорида меди равна 99,5 г/моль. Какова формула хлорида меди?
9. Для растворения 16,8 г металла потребовалось 14,7 г серной кислоты. Определить эквивалентную массу металла и объем выделившегося водорода (условия нормальные).
10. На восстановление 1,8 оксида металла израсходовано 833 мл водорода, его объем измерен при нормальных условиях. Вычислить эквивалентные массы оксида и металла.
11. Некоторое количество металла, эквивалентная масса которого равна 27,9 г/моль, вытесняет из кислоты 700 мл водорода, измеренного при нормальных условиях. Определить массу металла.
12. 1,6 г кальция и 2,61 г цинка вытесняют из кислоты одинаковое количество водорода. Вычислить эквивалентную массу цинка, зная, что эквивалентная масса кальция равна 20 г/моль.
13. При взаимодействии ортофосфорной кислоты со щелочью образовалась соль NaH2PO4. Найти для этого случая значение экви-валентной массы ортофосфорной кислоты.
14. На нейтрализацию 2,45 г кислоты идет 2 г гидроксида натрия. Определить эквивалентную массу кислоты.
15. При взаимодействии 5,95 г некоторого вещества с 2,75 г хлоро-водорода получилось 4,4 г соли. Вычислить эквивалентные массы ве-щества и образовавшейся соли.
16. 0,376 г алюминия при взаимодействии с кислотой вытеснили 0,468 л водорода, измеренного при нормальных условиях, определить эквивалентный объем водорода, зная, что эквивалентная масса алюми-ния равна 8,99 г/моль.
17. Сколько молекул
диоксида углерода находится в 1 л воздуха,
если объемное содержание
![]() составляет 0,03% (условия нормаль-ные)?
составляет 0,03% (условия нормаль-ные)?
18. Определить
объем, занимаемый 0,07 кг азота при
![]() и давлении 142 кПа (1065 мм рт. ст.).
и давлении 142 кПа (1065 мм рт. ст.).
19. Бертолетова
соль при нагревании разлагается с
образованием
![]() и
и
![]() .
Сколько литров кислорода при температуре
.
Сколько литров кислорода при температуре
![]() и давлении 101,3 кПа можно получить из 1
моля
и давлении 101,3 кПа можно получить из 1
моля
![]() ?
?
20. После взрыва 0,02 л смеси водорода и кислорода осталось не прореагировавшим 0,0032 л кислорода. Выразить в процентах по объему первоначальный состав смеси.
21. Масса 200 мл ацетилена при нормальных условиях равна 0,232 г. Определить мольную массу ацетилена.
22. Вычислить мольную массу газа, если масса 600 мл его при нормальных условиях равна 1,714 г.
23. Масса 0,001
![]() газа равна (при
,
101,33 кПа) 1,25 г. Вычислить: а) мольную массу
газа, б) массу одной молекулы газа.
газа равна (при
,
101,33 кПа) 1,25 г. Вычислить: а) мольную массу
газа, б) массу одной молекулы газа.
24. Масса 0,001 газа при нормальных условиях равна 0,0021 кг. Определить мольную массу газа и его плотность по воздуху.
25. Из скольких атомов состоят в парах молекулы ртути, если плотность паров ртути по воздуху равна 6,92?
26. Какой объем
займет 1 кг воздуха при
![]() и давлении 101,33 кПа?
и давлении 101,33 кПа?
27. Вычислить массу 1 воздуха при и давлении 83,2 кПа
(624 мм рт. ст.).
28. Найти простейшую формулу вещества, содержащего (по массе) 43,4% натрия, 11,3% углерода и 45,3% кислорода.
29. Найти простейшую формулу оксида ванадия, зная, что 2,73 г оксида содержат 1,53 г металла.
30. Вещество содержит (по массе) 26,53% калия, 35,37% хрома и 38,1% кислорода. Какова его простейшая формула?
31. Найти молекулярную формулу вещества, содержащего (по массе) 93,75% углерода и 6,25% водорода, если плотность этого вещества по воздуху равна 4,41.
32. Вычислить массу
азота, содержащегося в 1кг: а) калийной
селитры
![]() ;
б) аммиачной селитры; в) аммофоса
;
б) аммиачной селитры; в) аммофоса![]() .
.
33. Какую массу
железа можно получить из 2 т железной
руды, содержащей 94% по массе
![]() ?
?
34. К раствору, содержащему 10 г серной кислоты, прибавили 9 г гидроксида натрия. Какую реакцию имеет полученный раствор?
35. Раствор, содержащий
34 г
![]() ,
смешивают с раствором, содержащим такую
же массу хлорида натрия. Весь ли нитрат
серебра вступит в реакцию? Сколько
граммов
,
смешивают с раствором, содержащим такую
же массу хлорида натрия. Весь ли нитрат
серебра вступит в реакцию? Сколько
граммов
![]() получилось в результате реакции?
получилось в результате реакции?
36.
При сжигании 3 г антрацита получилось
5,3 л
![]() ,
измере-нного
при нормальных условиях. Сколько
процентов углерода по массе содержит
антрацит?
,
измере-нного
при нормальных условиях. Сколько
процентов углерода по массе содержит
антрацит?
37. К раствору,
содержащему 6,8 г трихлорида алюминия,
прилили раствор, содержащий 5 г
![]() .
Найти массу образовавшегося осадка.
.
Найти массу образовавшегося осадка.
38. Через раствор, содержащий 7,4 г гидроксида кальция, пропус-тили 3,36 л диоксида углерода, взятого при нормальных условиях. Найти массу вещества, образовавшегося в результате реакции.
39. Сколько граммов хлорида аммония образуется при смешении 7,3 г HCl с 4 г аммиака? Найти массу оставшегося после реакции газа.
40. Какова масса
природного известняка, содержащего 90%
(массовых)
![]() ,
потребуется для получения 7 тонн негашеной
извести. Карбонат кальция разлагается
на СаО
и
при нагревании.
,
потребуется для получения 7 тонн негашеной
извести. Карбонат кальция разлагается
на СаО
и
при нагревании.
Написать формулы ангидридов указанных кислот:
![]() ,
,
![]() ,
,
![]() ,
,
![]() ,
,
![]() .
.
42. Написать формулы
оксидов, соответствующих указанным
гидроксидам:
![]() ,
,
![]() ,
,
![]() ,
,
![]() ,
,
![]() .
.
43. Составить уравнения реакций, с помощью которых можно осуществить указанные превращения:
![]() ;
;![]()
![]() .
.
44. Написать уравнения реакций, с помощью которых можно осуществить следующие превращения:
![]() ,
,
![]() ,
,
![]() ,
,
![]() .
.
Как доказать амфотерный характер соединений:
ZnO,
![]() ,
,
![]() ,
,
![]() ?
?
46. Можно ли осуществить в растворах указанные ниже реакции:
![]() ;
;
![]() ;
;
![]() ?
?
Дать мотивированный ответ.
47. Какие кислоты
могут быть получены непосредственным
взаимодействием с водой оксидов:
![]() ,
,
,
,
![]() ,
,
![]() ?
?
48. С какими из
перечисленных ниже веществ будет
реагировать соляная кислота:
,
![]() ,
СаО,
,
,
СаО,
,
![]() ,
?
,
?
Составить уравнения реакций.
49. Написать уравнения
реакций, свидетельствующих об основных
свойствах FeO,
![]() ,
HgO,
,
HgO,
![]() .
.
Написать уравнения реакций, доказывающих кислотный характер:
 ,
,
 ,
,
 ,
,
,
,
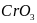 .
.
51. Сколько значений магнитного квантового числа возможно для электронов энергетического подуровня, орбитальное квантовое число которого равно l=2? l=3?
52. Какое максимальное число электронов может содержать атом в электронном слое с главным квантовым числом n=4?
Определить по правилу Клечковского последовательность заполнения электронных орбиталей, характеризующихся суммой n+l:
а) 5, б) 6 и в) 7.
54. Указать порядковый номер элемента, у которого: а) заканчи-вается заполнение электронами орбитали 4d; б) начинается заполнение подуровня 4р.
55. У какого элемента начинает заполняться подуровень 4f? У ко-торого элемента завершается заполнение этого подуровня?
56. Какой подуровень заполняется в атомах после заполнения подуровня 5р? После заполнения подуровня 5d?
57. Записать электронные формулы атомов элементов с зарядом ядра:
а) 8, б) 13, в) 18, г) 23, д) 53, е) 63, ж) 83.
Составить схемы заполнения электронных орбиталей этих атомов.
Сколько вакантных 3d-орбиталей имеют возбужденные атомы:
а) хлора, б) ванадия, в) марганца?
59.Сколько неспаренных электронов содержат невозбужденные атомы:
а) хлора, б) бора, в) серы, г) хрома, д) ртути, е) европия?
60. Составить
электронно-графические схемы ионов
![]() и
и
![]() .
Чем можно объяснить особую устойчивость
электронной конфи-гурации иона
?
.
Чем можно объяснить особую устойчивость
электронной конфи-гурации иона
?
61. Структура
валентного электронного слоя атома
элемента выражается формулой : а)
![]() ,
б)
,
б)
![]() .
Определить поряд-ковый номер и название
элемента.
.
Определить поряд-ковый номер и название
элемента.
Написать электронные формулы ионов:
а)
![]() ,
б)
,
б)
![]() ,
в)
,
в)
![]() ,
г)
,
г)
![]() ,
д)
,
д)
![]() ,
е)
,
е)
![]() .
.
63. На каком основании хром и сера, фосфор и ванадий расположены в одной группе периодической системы? Почему их помещают в разных подгруппах?
Для атома углерода значения последовательных потенциалов ионизации составляют в вольтах:
![]() =11,3
,
=11,3
,
![]() =24,4
,
=24,4
,
![]() =47,9
,
=47,9
,
![]() =64,
=64,
![]() =392.
=392.
Объяснить: а) ход изменения потенциалов ионизации; б) чем выз-ван резкий скачок при переходе от к .
65. Значения первых потенциалов ионизации элементов I группы периодической системы элементов соответственно равны (в В): Li=5,4, Cs=3,9 , Cu=7,7 , Ag=9,2. Указать: а) у элементов какой подгруппы I группы металлические свойства выражены более резко; б) чем объяснить различный ход изменения значений потенциалов ионизации в подгруппах ?
66. Как изменится с ростом порядкового номера значение первого потенциала ионизации у элементов второго периода? Чем объяснить, что первый потенциал ионизации атома Be больше, чем у атомов Li и В?
67. Указать тип
химической связи в молекулах
![]() ,
,
![]() ,
HCl,
привести схему перекрывания электронных
облаков.
,
HCl,
привести схему перекрывания электронных
облаков.
68. Вычислить разность относительных электроотрицательностей атомов для связей Н-О и О-Г ( где Г - это Cl, Br, I) в соединениях НОГ и определить:
а) какая из связей характеризуется большей степенью ионности;
б) каков характер диссоциации молекул в водном растворе.
69. Вычислить
разность относительных электроотрицательностей
атомов для связей Н-О
и О-As.
Какая из связей более полярна? К какому
классу гидроксидов относится
![]() ?
?
70. Как изменяется прочность связи в ряду: HF - HCl - HBr - HI? Назовите причины этих изменений.
71. Длина диполя
молекулы фтороводорода равна
![]() м.
Вычислить ее дипольный момент в Дебаях
и в кулон-метрах.
м.
Вычислить ее дипольный момент в Дебаях
и в кулон-метрах.
72. Дипольные моменты
молекул
![]() и
и
![]() равны соответственно 1,84 и 0,94 Дебай.
Вычислить длины диполей. В какой молекуле
связь более полярна? Указать направления
дипольных моментов связей в этих
молекулах.
равны соответственно 1,84 и 0,94 Дебай.
Вычислить длины диполей. В какой молекуле
связь более полярна? Указать направления
дипольных моментов связей в этих
молекулах.
73. Указать тип
гибридизации атомных орбиталей кремния
в молекулах
![]() и
и
![]() .
Полярны ли эти молекулы?
.
Полярны ли эти молекулы?
74. Исходя из представлений о природе ионной связи, объяснить, почему при обычных условиях ионные соединения существуют в виде ионных кристаллов, а не в виде отдельных молекул?
75. Температура
плавления
![]() -
-
![]() ,
,
![]() -
-
![]() ;
радиус иона
;
радиус иона
![]() равен 0,104 нм, иона
равен 0,104 нм, иона
![]() - 0,099 нм. Объяснить различие температур
плавления.
- 0,099 нм. Объяснить различие температур
плавления.
76. При соединении 2,1 г железа с серой выделилось 3,77 кДж. Рассчитать теплоту образования сульфида железа. При решении задач следует пользоваться справочными данными (табл. приложения).
77. Исходя из теплового эффекта реакции
![]() (к);
(к);
![]() -
739 кДж,
-
739 кДж,
определить
![]() образования ортофосфата кальция.
образования ортофосфата кальция.
78. При восстановлении 12,7 г. оксида меди (II) углем (с образо-ванием СО) поглощается 8,24 кДж. Определить образования CuO.
79. Водяной газ представляет собой смесь равных объемов водо-рода и оксида углерода (II). Найти количество теплоты, выделяющейся при сжигании 112 л водяного газа, взятого при нормальных условиях.
80. Исходя из
образования
(г.) и ее
![]() ,
а также следующих данных:
,
а также следующих данных:
FeO (k) + CO (г.)=Fe (к.) + (г.), = - 18,2 кДж,
2СО (г.) +
=2![]() x=
- 566 кДж,
x=
- 566 кДж,
вычислить -реакции :
![]()
81. Найти значение
константы скорости реакции
А+В![]() АВ,
если при концентрациях веществ А и В,
равных соответственно 0,05 и 0,01 моль/л.
Скорость реакции равна 510
АВ,
если при концентрациях веществ А и В,
равных соответственно 0,05 и 0,01 моль/л.
Скорость реакции равна 510![]() моль/(л*мин).
моль/(л*мин).
82. Во
сколько раз изменится скорость реакции
2А+В
![]() ,если
концентрацию вещества А
увеличить в 2 раза, а концентрацию
вещества В
уменьшить в 2 раза?
,если
концентрацию вещества А
увеличить в 2 раза, а концентрацию
вещества В
уменьшить в 2 раза?
83. Как изменится
скорость реакции
![]() ,
если: а) увеличить давление в системе в
3 раза; б) уменьшить объем системы в 3
раза; в) повысить концентрацию
,
если: а) увеличить давление в системе в
3 раза; б) уменьшить объем системы в 3
раза; в) повысить концентрацию
![]() в 3 раза?
в 3 раза?
84. Две реакции
протекают при
![]() с одинаковой скоростью. Температурный
коэффициент скорости первой реакции
равен 2, а второй - 2,5. Найти отношение
скоростей этих реакций при
с одинаковой скоростью. Температурный
коэффициент скорости первой реакции
равен 2, а второй - 2,5. Найти отношение
скоростей этих реакций при
![]() .
.
85. Температурный коэффициент скорости некоторой реакции равен 2,3. Во сколько раз увеличится скорость реакции, если повысить температуру на ?
86. При
![]() некоторая реакция заканчивается за 16
мин. Принимая температурный коэффициент
скорости реакции равным 2,5, рассчитать,
через какое время закончится эта реакция,
если проводить ее: а) при
некоторая реакция заканчивается за 16
мин. Принимая температурный коэффициент
скорости реакции равным 2,5, рассчитать,
через какое время закончится эта реакция,
если проводить ее: а) при
![]() ; б) при
; б) при
![]() .
.
87. Чему равна энергия активации реакции, если при повышении температуры от 290 до 300 К скорость ее увеличивается в 2 раза?
88. Каково значение энергии активации реакции, скорость которой при 300 К в 10 раз больше, чем при 280 К?
89. В каком направлении сместятся равновесия:
![]() ;
;
![]() =
- 566 кДж
=
- 566 кДж
![]() ;
=180
кДж,
;
=180
кДж,
а) при понижении температуры; б) при повышении давления?
90. Сколько граммов
![]() потребуется для приготовления 5 л 8%-ного
раствора (по массе) с плотностью
=1,075 г/мл?
потребуется для приготовления 5 л 8%-ного
раствора (по массе) с плотностью
=1,075 г/мл?
91. 1 мл 25%-ного (по массе) раствора содержит 0,458 г раство-ренного вещества. Какова плотность этого раствора?
92. Определить массовую долю вещества в растворе, полученном смешением 300 г 25%-ного раствора и 400 г 40%-ного (по массе) раствора этого вещества.
93. Какой объем воды надо прибавить к 100 мл 20%-ного (по массе) раствора серной кислоты с плотностью 1,14 г/мл, чтобы получить 5%-ный раствор?
94. К 500 мл 32%-ной (по
массе)
![]() (
=1,2 г/мл) прибавили 1 л воды. Чему равна
массовая доля
в полученном растворе?
(
=1,2 г/мл) прибавили 1 л воды. Чему равна
массовая доля
в полученном растворе?
95. Плотность 26%-ного (по массе) раствора КОН равна 1,24 г/мл. Сколько молей КОН находится в 5 л раствора?
96. Для приготовления
5%-ного (по массе) раствора сернокислого
магния взято 400 г
![]() .
Найти массу полученного раствора.
.
Найти массу полученного раствора.
97. Определить
массовую долю
![]() в растворе, полученном при растворении
50 г медного купороса
в растворе, полученном при растворении
50 г медного купороса
![]() в 450 г воды.
в 450 г воды.
98. Для нейтрализации 30 мл 0,1 нормального раствора щелочи потребовалось 12 мл раствора кислоты. Определить нормальность кислоты.
99. Найти молярность 36,2%-ного (по массе) раствора HCl, плот-ность которого 1,18 г/мл.
Сколько миллилитров 96%-ного (по массе) раствора ( =1,84 г/мл) нужно взять при приготовлении 1 л 0,25 н. раствора?
101. Какой объем 10%-ной (по массе) серной кислоты ( =1,07 г/мл) потребуется для нейтрализации раствора, содержащего 16 г NaOН?
102. Какой объем 0,2
н. Раствора щелочи потребуется для
осаж-дения в виде
всего железа, содержащегося в 100 мл 0,5
н. раствора
![]() ?
?
103. Сколько граммов
![]() выпадает в осадок, если к 400 мл 0,5 н.
раствора CaCl2
прибавить
избыток раствора соды?
выпадает в осадок, если к 400 мл 0,5 н.
раствора CaCl2
прибавить
избыток раствора соды?
104. На нейтрализацию 20 мл раствора, содержащего в 1 л 12 г щелочи, израсходовано 24 мл 0,25 н. раствора кислоты. Рассчитать эквивалентную массу щелочи.
105. На нейтрализацию раствора, содержащего 2,25 г кислоты. Потребовалось 25 мл 2 н. раствора щелочи. Определить эквивалентную молекулярную массу кислоты.
106. Раствор, в 100 мл которого находится 2,3 г вещества, обладает при 298 К осмотическим давлением, равным 618,5 кПа. Определить молекулярную массу вещества.
107. Сколько молей неэлектролита должен содержать 1 л раствора, чтобы его осмотическое давление при было равно 2,47 кПа?
108. На сколько
градусов повысится температура кипения
воды, если в 100 г воды растворить 9 г
глюкозы
![]() ?
?
109. Водный раствор
спирта, содержащий 15% спирта (![]() =0,97
г/мл), кристаллизуется при
=0,97
г/мл), кристаллизуется при
![]() .
Найти молекулярную массу спирта и
осмотическое давление раствора при 293
К.
.
Найти молекулярную массу спирта и
осмотическое давление раствора при 293
К.
110. Какова молярность
раствора неэлектролита, если при
![]() С
его осмотическое давление равно 2,27 кПа?
С
его осмотическое давление равно 2,27 кПа?
111. Степень
диссоциации угольной кислоты
![]() на первой ступени в 0,1 н. растворе равна
на первой ступени в 0,1 н. растворе равна
![]() .
Вычислить константу диссоциации
.
Вычислить константу диссоциации
![]() .
.
112. Раствор,
содержащий 0,53 г карбоната натрия в 200 г
воды, кристаллизуется при
![]() .
Вычислить кажущуюся степень диссоциации
соли.
.
Вычислить кажущуюся степень диссоциации
соли.
113. Вычислить
приближенное значение активности ионов
![]() и
и
![]() в 0,01 М растворе
в 0,01 М растворе
![]() .
.
114. Вычислить
приближенное значение активности ионов
![]() и
и
![]() в 0,002 н. растворе
в 0,002 н. растворе
![]() .
.
115. Вычислить ионную силу и активность ионов в 0,1%-ном (по массе) растворе . Плотность раствора принять равной единице.
116. Рассчитать активности иона водорода в 0,005 н. растворе HCl, содержащем, кроме того, 0,15 моль/л хлористого натрия.
117. Вычислить рН
растворов, в которых концентрация ионов
![]()
(в моль/л) равна:
а)
![]() ;
б)
;
б)
![]() ;
в)
;
в)![]() .
.
118. Вычислить рН
растворов, в которых концентрация ионов
![]() (в моль/л) равна:
(в моль/л) равна:
а)
![]() ;
б)
;
б)
![]() ;
в)
;
в)
![]() .
.
119. Вычислить рН 0,01 н. раствора уксусной кислоты, в котором степень диссоциации кислоты равна 0,042.
120. Определить и в растворе, рН которого равна 6,2.
121. Как изменится
рН воды, если к 10 л ее добавить
![]() моль NaOH:
моль NaOH:
а) возрастет на 2; б) возрастет на 3; в) возрастет на 4; г) уменьшится на 4?
Написать в ионно-молекулярной форме уравнения реакций, приводящих к образованию малорастворимых осадков или газов:
а)
![]() ;
б)
;
б)
![]() ;
в)
;
в)
![]() ;
;
г)
![]() ;
д)
;
д)
![]() .
.
123. Написать в ионно-молекулярной форме уравнения реакций нейтрализации:
а)
![]() ;
б) HF+KOH;
в)
;
б) HF+KOH;
в)
![]() ;
;
г)
![]() ;
д)
;
д)
![]() .
.
124. Вычислить константу гидролиза фторида калия, определить степень гидролиза этой соли в 0,01 М растворе и рН раствора.
125. Вычислить константу гидролиза хлорида аммония, опре-делить степень гидролиза этой соли в 0,01 М растворе и рН раствора.
Какие из перечисленных ниже солей, подвергаясь частичному гидролизу, образуют основные соли:
а)![]() ;
б)
;
б)
![]() ;
в)
;
г)
;
в)
;
г)
![]() .
.
Определить степень окисленности серы в следующих соеди-нениях: ,
 ,
,
 ,
,
 ,
,
,
,
 .
.
128. Определить степень окисленности хрома в следующих соеди-нениях:
![]() ,
,
![]() ,
,
![]() ,
,
![]() ,
.
,
.
Указать, в каких из приведенных процессов происходит окисление азота, а в каких - восстановление, как изменяется в каждом случае степень окисленности азота:
![]() ;
;
![]() ;
;
![]() ;
;
![]() .
.
130. Какие из следующих реакций относятся к окислительно-восстановительным?
а)
![]() ,
б)
,
б)
![]() ,
,
в)
![]() ,
,
г)
![]() ,
,
д)
![]() ,
е) Fe+S=FeS.
,
е) Fe+S=FeS.
131 . Для следующих реакций указать, какие вещества и за счет каких именно элементов играют роль окислителей и какие-восстановителей:
а) SO![]() + Br
+ 2 H
O
= 2 H Br + H
S
O
+ Br
+ 2 H
O
= 2 H Br + H
S
O![]() ,
,
б) Mg + H
SO
= MgSO
+ H![]() ,
,
в) Cu + 2H
SO![]() = CuSO
+ SO
+ 2 H
O,
= CuSO
+ SO
+ 2 H
O,
г) 3I
+
6KOH = KIO
![]() + 5KI + 3 H
0.
+ 5KI + 3 H
0.
132 . В каких из указанных превращений кислород выполняет функции восстановителя:
а)
2Ag
O
![]() 4Ag + O
,
б)
2F
+ 2H
O
4HF + O
,
4Ag + O
,
б)
2F
+ 2H
O
4HF + O
,
в) 4N H + 3O 2N + 6H O,
г) 2AgNO + 2KOH + H O 2Ag + 2KNO + O + 2Н2О.
133. На основе электронного строения атомов указать, могут ли быть окислителями: атомы натрия, кислород в степени окисления -2 , йод в степени окисления 0, фторид-ионы, катионы водорода, нитрит-ионы, гидрид-ионы.
Какие из перечисленных веществ и за счет каких элементов проявляют обычно окислительные свойства и какие – восстано-вительные? Указать те из них, которые обладают окислительно-восстановительной двойственностью:
H S, SO , CO , CO, Zn, F , NaNO , KMnO , HOCl, H SbO .
135. Указать, в каких из следующих реакций пероксид водорода служит окислителем, а в каких - восстановителем:
а) I + H O HIO + H O;
б) PbO + H O Pb ( OН ) + O ;
в) K Cl O + H O K Cl + 2O + H O;
г) K Mn O + H O Mn O + K O H + O + H O.
136. Составить уравнения полуреакций окисления и восста-новления, в которых водород служит окислителем или восстано-вителем, и указать конкретно роль водорода в каждой реакции:
а) 2 Al + 6HCl = 2AlCl + 3H ;
б) 2H + O = 2H O; в) 2Na + 2H O = 2NaOH + H ;
г) BaH + 2H O = Ba ( OH ) + 2H .
137. Закончить уравнения реакций:
а) Mn ( OH ) + Cl + KOH = MnO + ;
б) MnO + O + KOH = K MnO +;
в) FeSO + Br + H SO = ;
г) NaAsO + I + NaOH = Na AsO + .
138. Закончить уравнения реакций, в которых окислителем служит концентрированная азотная кислота:
а) C + HNO CO + ; б) Sb + HNO HSbO + ;
в) Bi + HNO Bi ( NO ) + ;
г) PbS + HNO PbSO + NO + .
139. Закончить уравнения реакций, в которых окислителем служит концентрированная серная кислота:
а) HBr + H SO Br + ; б) S + H SO SO + ;
в) Mg + H SO MgSO + .
140. Закончить уравнения реакций, в которых окислитель (или восстановитель) дополнительно расходуется на связывание продуктов реакции:
а) HBr + KMnO MnBr + ; б) HCl + CrO Cl + ;
в) NH (избыток) + Br N + ; г) Cu O + HNO NO + .
141. Закончить уравнения реакций:
а) K S + K MnO + H O S + ;
б) NO + KMnO + H O KNO + ;
в)
KI + K
Cr
O![]() + H
SO
I
+ ;
+ H
SO
I
+ ;
г) Ni ( OH ) + NaClO + H O Ni ( OH ) + .
142. Закончить уравнения реакций внутримолекулярного окисле-ния-восстановления. Какой атом или ион выполняет в данном случае роль окислителя, какой восстановителя?
а) CuI CuI + I ; б) Pb ( NO ) PbO + NO + ;
в) KClO KCl + ; г) NH NO N + .
143. Вычислить
эквивалентную массу H
SO![]() в следующих
реакциях:
в следующих
реакциях:
а) Zn + H SO (разбавл.) = ZnSO + H ;
б) 2HBr + H S O (конц.) = Br + SO + 2H O;
в) 8HI + H SO (конц.) = 2I + H S + 4H .
144. Железная пластинка погружена в раствор CuSO . После окончания реакции масса пластинки увеличилась на 2 грамма. Найти массу выделившейся из раствора меди.
145. Составить схемы двух гальванических элементов, в одном из которых медь служила бы катодом, а в другом - анодом. Написать уравнения реакций, происходящих при работе этих элементов, и вычислить значения стандартных э.д.с..
146. В каком направлении будут перемещаться электроны во внешней цепи следующих гальванических элементов:
а) Mg
/ Mg![]() / / Pb
/ Pb;
/ / Pb
/ Pb;
б) Pb
/ Pb
/ / Cu
/ Cu ; в) Cu
/ Cu
/ / Ag![]() / Ag,
/ Ag,
если все растворы электролитов одномолярные?
Какой металл будет растворяться в каждом из этих случаев?
147. Гальванический элемент состоит из серебряного электрода, погруженного в 1 М раствор AgNO , и стандартного водородного электрода. Написать уравнения электродных процессов и суммарной реакции, происходящей при работе элемента. Чему равна его э.д.с.?
148. Рассчитать электродные потенциалы магния в растворе его соли при концентрациях иона Mg 0,1; 0,01; 0,001 моль/л.
149. Вычислить потенциал водородного электрода, погруженного в чистую воду; в раствор с pH=3,5; в раствор с pH=10,7.
150. Э.д.с. элемента, состоящего из медного и свинцового электродов, погруженных в 1 М растворы солей этих металлов равна 0,47 В. Измениться ли э.д.с., если взять 0,001 М растворы? Ответ обосновать.
151. Гальванический
элемент составлен из стандартного
цинкового электрода и хромового
электрода, погруженного в раствор,
содер-жащий ионы Cr![]() .
При какой концентрации ионов Cr
э.д.с. этого элемента будет равна нулю?
.
При какой концентрации ионов Cr
э.д.с. этого элемента будет равна нулю?
152. Э.д.с. гальванического элемента, составленного из двух водородных электродов, равна 272 мВ. Чему равен рH раствора, в котором погружен анод, если катод погружен в раствор с рH = 3?
153. Какие из приведенных ниже реакций могут протекать самопроизвольно?
а) H PO + 2HI = H PO + I + H O;
б) H PO + SnCl + H O = 2HCl + Sn + H PO ;
в) H PO + 2 AgNO + H O = 2Ag + 2HNO + H PO ;
г) H PO + Pb ( NO ) + H O = Pb + 2HNO + H PO .
154. Составить уравнения процессов, протекающих при электролизе расплавов NaOH, Pb ( NO ) , NiCl с инертными электродами.
155. Составить
схемы электролиза водных растворов
![]() с платиновыми электродами.
с платиновыми электродами.
156. Написать
уравнения электродных процессов,
протекающих при электролизе водных
растворов
и
![]() с инертным анодом.
с инертным анодом.
157. Составить схемы электролиза водного раствора сульфата меди, если: а) анод медный; б) анод угольный.
158. В какой последовательности будут выделяться металлы при электролизе раствора, содержащего в одинаковой концентрации сульфаты никеля, серебра, меди?
159. При
электролизе растворов
![]() на аноде выделилось
560 мл. газа (условия нормальные). Найти
массу меди, выделившейся на катоде.
на аноде выделилось
560 мл. газа (условия нормальные). Найти
массу меди, выделившейся на катоде.
Вычислить массу серебра, выделившегося на катоде при пропускании тока силой 6А через растворов нитрата серебра в течение 30 минут.
161. Чем обусловлена общность физических свойств металлов? Охарактеризовать эти свойства.
162. Пользуясь
данными, приведенными в таблице
«Стандартные энтальпии образования
![]() ,
энтропии
,
энтропии
![]() и
энергии Гиббса образования
и
энергии Гиббса образования
![]() »
приложения задачника [5], определить,
какая из приведенных ниже реакций может
происходить при стандартных условиях:
»
приложения задачника [5], определить,
какая из приведенных ниже реакций может
происходить при стандартных условиях:
WO (к.) + 3CO (г.) = W (к.) + 3CO2 (г.);
WO (к.) + 3C (графит) = W (к.) + 3CO (г.);
WO (к.) + 3Ca (к.) = W (к.) + 3CaO (к.).
163. Какой металл будет выделяться при охлаждении жидкого сплава меди и алюминия, содержащего 25% (масс.) меди, если эвтектика включает 32,5% (масс.) меди? Какую массу этого металла можно выделить из 200 г сплава?
Сплав олова со свинцом содержит 73% (масс.) олова. Найти массу эвтектики в 1 кг твердого сплава, если эвтектика включает 64% (масс.) олова?
165. Серебряные монеты обычно чеканят из сплава, состоящего из равных масс меди и серебра. Сколько граммов меди находится в 200 г такого сплава в виде кристаллов, вкрапленных в эвтектику, если последняя содержит 28% (масс.) меди?
166. Какую формулировку периодического закона дал Д. И. Менделеев? Какова современная формулировка периодического закона? В чем их сходство и различие?
167. По какому принципу элементы объединяются в группы и подгруппы?
168. Почему у элемента VII группы - марганца преобладают металлические свойства, тогда как стоящие в той же группе галогены являются типичными неметаллами? Дать ответ, исходя из строения атомов указанных элементов.
169. В чем проявляется диагональное сходство элементов? Какие причины его вызывают? Сравнить свойства бериллия, магния и алюминия.
170. Чем объяснить сходство химических свойств лантаноидов. Напишите электронную формулу лантана.
171. С каким элементом более сходен молибден по свойствам - с селеном или с хромом? Чем это объясняется?
172. Исходя из положения элементов в периодической системе, определить:
а) у какого из
гидроксидов:![]() или
или
![]() -
более выражены основные свойства; б)
какой из оксидов является более сильным
окислителем:
-
более выражены основные свойства; б)
какой из оксидов является более сильным
окислителем:
![]() или
или
![]() ?
?
173. Описать электронное строение атомов водорода - протия, дейтерия и трития. В чем их различие? Какие изотопы водорода более стабильны?
174. В виде каких ионов может входить водород в состав химических соединений?
175. Почему в периодической системе элементов водород относят как к I, так и к VII группе?
176. Как получают водород в промышленности и в лаборатории? Привести уравнения реакций.
177. Как получают гидриды металлов? Составить уравнения реакций: а) получения гидрида кальция; б) взаимодействия его с водой.
178. Указать способы
получения пероксида водорода. Описать
строение молекулы
![]() .
Почему она полярна?
.
Почему она полярна?
179. Исходя из строения атомов галогенов, указать, какие валентные состояния характерны для фтора, хлора, брома и йода. Какие степени окисленности проявляют галогены в своих соединениях?
180. Составить схему цепной реакции хлора с водородом. Какую роль в ней играет освещение? Имеет ли влияние на реакцию частота светового излучения?
181. Дать сравнительную характеристику свойств галогено-водородов, узнав характер изменения: а) температур кипения и плав-ления; б) термической устойчивости; в) восстановительных свойств.
182. Исходя из строения атома кислорода, указать его валентные возможности. Какие степени окисленности проявляет кислород в соединениях?
183. Указать лабораторные и промышленные способы получения кислорода, привести сведения о важнейших областях его применения.
184. Описать
электронное строение молекулы озона
![]() ,
сравнить химическую активность озона
и молекулярного кислорода
.
Как получить озон из молекулярного
кислорода?
,
сравнить химическую активность озона
и молекулярного кислорода
.
Как получить озон из молекулярного
кислорода?
185. Исходя из строения атомов серы, селена и теллура, указать какие валентные состояния и степени окисленности характерны для элементов. Каковы формулы их высших гидроксидов?
186. Составить уравнения реакций: а) концентрированной серной кислоты с магнием и серебром; б) разбавленной серной кислоты с железом.
187. Дать сравнительную характеристику атомов элементов подгруппы азота, указав: а) электронные конфигурации; б) валентные возможности; б) наиболее характерные степени окисленности в их соединениях.
188. Привести примеры реакций, в которых азот играет роль окислителя, а также пример реакции, в которой он является восс-тановителем.
189. Указать химические свойства фосфора и написать формулы кислородосодержащих кислот фосфора.
190. Как изменяются кислотно-основные свойства в ряду гидроксидов мышьяка (III), сурьмы (III), висмута (III)? Привести примеры реакций.
191. Охарактеризовать аллотропные модификации углерода и объяснить причину различия их свойств.
192. Описать свойства оксида углерода (II), указав: а) электронное строение молекулы с позиций методов ВС и МО; б) отношение к воде и водным растворам кислот и щелочей; в) окислительно-восстанови-тельные свойства.
193. Дать краткую характеристику кремния, указав: а) электронное строение атома и его валентные возможности; б) химические свойства свободного кремния, а также его диоксида.
194. Опишите химические свойства элементов I группы таблицы Менделеева. Чем объясняются различия в свойствах элементов главной и побочной подгрупп I группы?
195. Рассмотреть особенности строения атомов элементов II группы. Как изменяются химические свойства и первый потенциал ионизации с ростом порядкового номера элементов в главной и побочной подгруппах таблицы Д. И. Менделеева?
196. Рассмотрите особенности строения атомов III А подгруппы третьей группы таблицы элементов. Какие валентные состояния характерны для этих элементов? Как изменяются их свойства с увеличением порядкового номера элемента?
Химические свойства бора и алюминия. Какие свойства проявляют тригидроксиды бора и алюминия в реакциях со щелочными металлами и с соляной кислотой?
Описать оксиды германия, олова и свинца. Как изменяются кислотно-основные свойства гидроксидов в рядах:
![]() и
и
![]() ?
?
Какие химические свойства имеют элементы подгруппы железа? В какие реакции вступает железо, никель и кобальт с кислотами и щелочами?
Опишите физико-химические свойства благородных газов VIII группы. Какие химические соединения и при каких условиях они образуют?
