
- •Химическая переработка углеводородных газов и газоконденсатов, состояние и перспективы развития в россии и за рубежом
- •Процессы химической переработки углеводородных газов, реализованные в промышленности. Перспективные направления химической переработки углеводородных газов
- •Газохимия на предприятиях оао газпром, состояние и перспективы
- •Пиролиз метана с целью получения ацетилена. Разновидности процесса в зависимости от метода подвода тепла
- •Выделение ацетилена из газов пиролиза. Области его применения
- •Производство газообразных ненасыщенных углеводородов. Пиролиз как основной процесс производства. Факторы, влияющие на процесс.Химизм процесса.Принципиальная технологическая схема процесса
- •Поточная схема очистки и разделения газа пиролиза. Концентрирование этилена и пропилена
- •Новые виды пиролиза: в присутствии гетерогенных катализаторов, инициирующих добавок, гидропиролиз
- •Области применения газообразных олефинов
- •Каталитическое дегидрирование низших парафиновых углеводородов
- •Производство и применение изобутилена. Принципиальная технологическая схема дегидрирования изобутана в кипящем слое катализатора
- •Производство бутандиена и изопрена. Двухстадийное и одностадийное дегидрирование бутана. Технологическая схема процесса
- •Получение изопрена
- •Технология производства сажи. Классификация саж. Строение и свойства сажи
- •Дисперсность.
- •Структурность.
- •Поверхность частиц сажи и ее свойства.
- •Объемный вес.
- •Истинная плотность сажевых частиц.
- •Теплопроводность.
- •Производство сажи различными способами. Производство сажи термическим разложением без доступа воздуха. Получение сажи осаждением из диффузионного пламени
- •Печные способы производства. Технология производства печной газовой сажи
- •Методы улавливания и очистки сажи
- •Очистка сажи
- •Применение сажи
- •Классификация процессов полимеризации
- •Производство полиэтилена низкой плотноти при высоком давлении и высокой плотности при низком давлении
- •Производство полипропилена
- •Получение олистирола. Свойства и применения полистирола
- •Каучуки общего назначения
- •Каучуки специального назначения
- •Основные закономерности окисления парафиновых углеводородов. Окисление как цепной радикальный процесс, механизм и основные стадии процесса. Особенности механизма газофазного окисления углеводородов
- •Окисление углеводородов, согласно теории акад. Н.Н. Семенова, является радикально-цепной реакцией с вырожденным разветвлением цепи.
- •Прямое окисление метана в газовой фазе. Трудности разделения продуктов реакции
- •Закономерности прямого окисления углеводородов
- •Жидкофазное окисление низших парафиновых углеводородов в кислоты
- •Получение синтез-газа конверсией метана с водяным паром. Условия процесса и технологическая схема
- •Углекислотная конверсия метана, применяемые катализаторы. Парциальное окисление метана. Новые модификации процесса получения синтез-газа
- •Новые модификации процесса получения синтез-газа.
- •Основные направления химической переработки синтез-газа
- •Производство на основе синтез-газа синтетических моторных топлив по методу фишера-тропша. Состав продуктов реакции в зависимости от применяемых катализаторов, температуры и давления. Схема
- •Производство метанола
- •Производство и применение формальдегида
- •Производство уксусной кислоты и мтбэ
- •Получение метилтретбутилового эфира (мтбэ)
- •Производство альдегидов и спиртов методом оксосинтеза
- •Гидроформилирование олефинов.
- •Варианты технологического оформления стадии гидроформилирования
- •Прямое окисление олефинов в альдегиды и кетоны
- •Окисление олефинов по метильной группе
- •Производство спиртов гидратацией газообразных олефинов
- •Сернокислотная гидратация низших олефинов
- •Прямая гидратация пропилена
Производство уксусной кислоты и мтбэ
Синтез уксусной кислоты из метанола и СО является экзотермической реакцией:
СН3ОН + СО СН3СООН + 174,6 кДж/моль.
Реакция до 300 °С необратима. Одновременно может образоваться метилацетат. Условия промышленного процесса и технология определяются применяемыми катализаторами.
По способу фирмы «ВАSF» процесс проводят в присутствии Со-катализатора СоI2 или Со (ОАс)2, промотированного I2 или его соединениями при температуре 210—250 °С и давлении СО 50—70 МПа, по способу фирмы «Моnsanto» в присутствии RhJ2, промотированного J2, при температуре 175—245 °С и давлении СО 0,1—2,0 МПа.
При проведении процесса по способу фирмы «BASF» увеличение давления в интервале 50—70 МПа не влияет на суммарную конверсию метанола, но приводит к росту образования СО2. При температуре ниже 180 °С скорость реакции мала; при 260 °С и выше усиливаются побочные реакции образования диметилового эфира и ацетальдегида. С учетом этих факторов процесс проводят при конверсии метанола 60—80%.
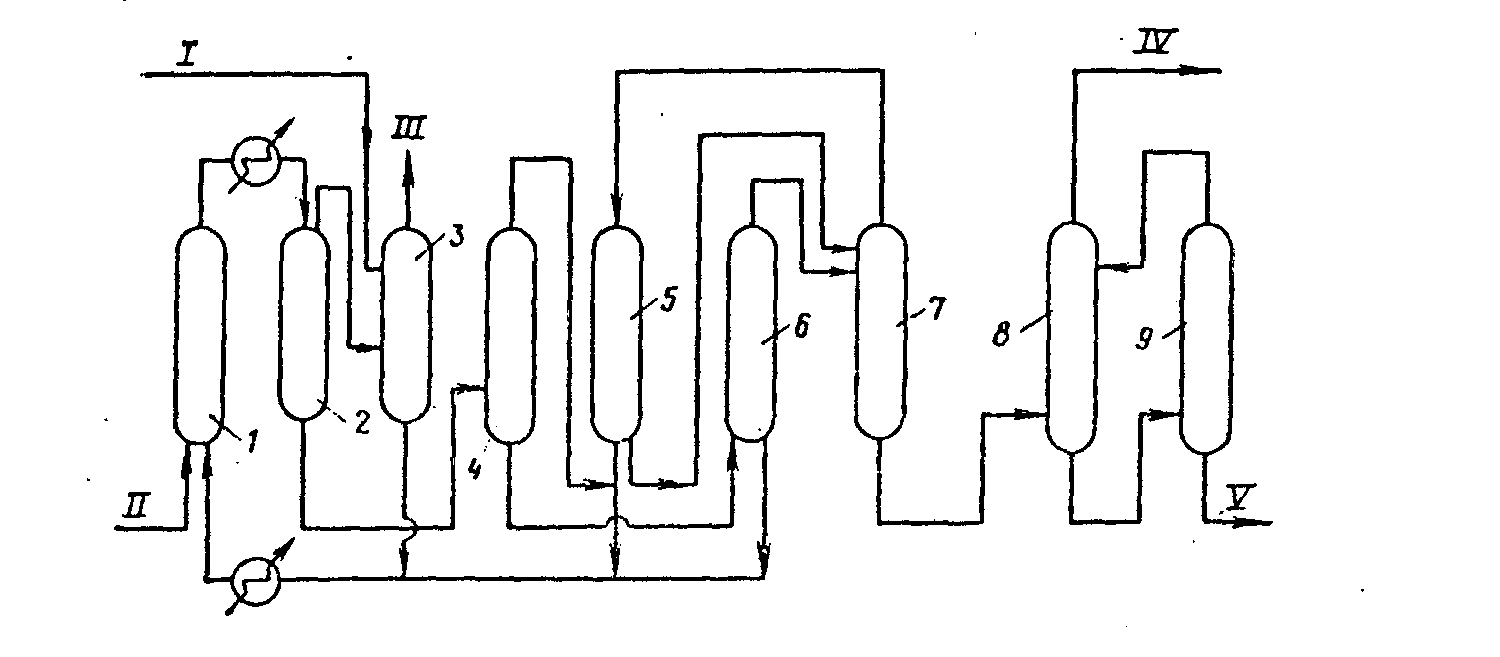
Принципиальная технологическая схема карбонилирования метанола по способу фирмы «ВАSF»:
I—реактор; 2—сепаратор высокого давления; 3—скруббер; 4—дегазатор; 5—сепаратор низкого давления; 6—колонна отделения катализатора; 7—колонна отделения воды; 8, 9 — ректификационные колонны. Потоки: /—метанол; //—СО; ///—абгаз; /V—уксусная кислота; V—побочные продукты.
В присутствии Rh-катализатора карбонилирование метанола протекает в более мягких условиях и более селективно, чем в случае Со-катализаторов. Скорость реакции прямо пропорциональна концентрации родия и галогенного промотора, концентрации метанола и парциальному давлению СО.
Реакционная смесь из реактора после охлаждения поступает в сепаратор высокого давления и далее в скруббер, где отмывается метанол, а СН3I и НI возвращаются в реактор. Далее жидкие продукты подвергаются дегазации, поступают в сепаратор низкого давления, затем в колонну отделения катализатора и далее в блок ректификации. В результате выделяют уксусную кислоту с концентрацией 99,8%. Выход составляет 80— 90% от метанола и 60—70% от СО. Побочные продукты возвращают в реактор. Теплота реакции полностью обеспечивает тепловой баланс в реакторе и, кроме того, используется для подогрева сырья до 40—80 °С. Для получения 1 т. уксусной кислоты расходуется 0,61 т метанола.
Выход уксусной кислоты по технологии «Моnsanto»: составляет 99% на метанол и 90% на СО.
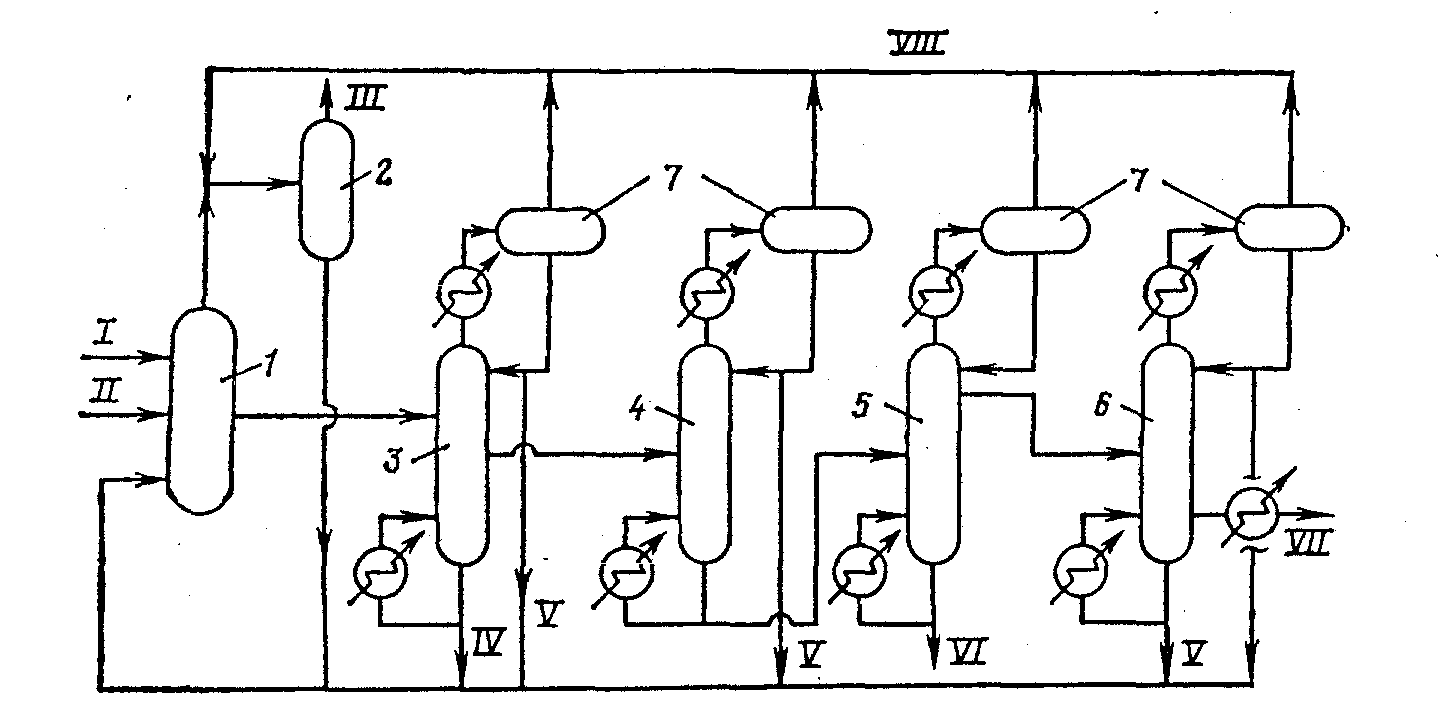
Принципиальная технологическая схема карбонилирования метанола по способу фирмы «Моnsanto»:
1—реактор; 2—скруббер; 3—сепаратор для отделения катализатора; 4—колонна для отделения воды; 5,6—ректификационные колонны; 7—холодильники. Потоки: /—СО; //—метанол; ///— абгаз; /V—рецикл катализатора; V—рецикл продуктов; VI—кубовый остаток; VII—уксусная кислота;. VIII—рецикл СHзI.
Получение метилтретбутилового эфира (мтбэ)
Важное место среди новых процессов переработки метанола, реализованных в промышленности, занимает производство метилтретбутилового эфира (МТБЭ). Его используют в качестве высокооктанового компонента моторных топлив (октановое число по исследовательскому методу 118). По сравнению со спиртами, которые также применяются в качестве добавок, повышающих октановое число бензинов, МТБЭ имеет ряд преимуществ: температура кипения (55оС) находится в пределах минимальной детонационной стойкости бензина (головная фракция до 100оС), плохая растворимость в воде, полное смешение с любыми углеводородами, низкая плотность. Добавка МТБЭ обеспечивает большую полноту сгорания и не требует изменений в конструкции двигателя. Введение МТБЭ в бензин взамен других кислородсодсодержащих и традиционных добавок (алкилат, изомеризат) значительно экономичнее.
МТБЭ получают из метанола и изобутилена по реакции:
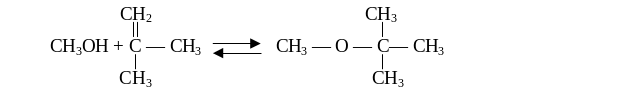
Побочные продукты образуются в незначительном количестве за счет реакций олигомеризации изобутилена и дегидратации спирта.
Применяют два вида катализаторов для этого процесса: гомогенные и гетерогенные кислотно-основного типа. В качестве гомогенных катализаторов предложены минеральные кислоты (серная, фосфорная, соляная, борная), катализаторы типа Фриделя-Крафтса, органические сульфокислоты. Наиболее эффективным катализатором является серная кислота. Основные недостатки гомогенных катализаторов – высокая коррозионная агрессивность и в большинстве случаев невысокая селективность процесса.
В качестве гетерогенных катализаторов предложены оксидные катализаторы как кислого (оксиды алюминия, железа, никеля, ванадия и других металлов в присутствии минеральных кислот – серной, азотной, фосфорной и др.), так и основного характера (оксид магния в присутствии гидроксида калия), активированные угли с функциональными сульфо- и карбоксильными группами, органомолибденовые соединения, минеральные и гетерополикислоты и их соли на твердом носителе, цеолиты, ионообменные смолы.
Синтез МТБЭ на гетерогенных катализаторах, в частности на цеолитах, можно осуществлять как в паровой (при атмосферном давлении), так и в жидкой фазе (давление 1,4-2,1МПа) при температуре 80-110оС. В паровой фазе выход МТБЭ значительно ниже, чем в жидкой (86-90%), но селективность выше. Активность цеолитов повышается с увеличением их кислотности. Наиболее эффективны для синтеза МТБЭ сульфированные ионообменные смолы – сульфокатиониты, еще более активны модифицированные катиониты, получаемые путем замещения части сульфогрупп (10-30%) катионами металлов (цинка, железа, хрома, меди, кобальта) и бифункциональные катализаторы, которые получают нанесением на сильнокислотные катиониты благородных металлов.
