
44.Томсон
предложил модель атома, согласно которой атом представ-
ляет собой равномерно заполненный положительным зарядом шар,
внутри которого находятся электроны. Суммарный положительный
заряд шара равен суммарному заряду электронов.
На основании опытов Резерфорд пришел к выводу,-
атомы состоят из ядра, малого по сравнению с размерами всего атома,
в котором сосредоточена почти вся масса атома. Вокруг ядра движутся
электроны, масса которых мала по сравнению с массой ядра.
Бор -постулаты:
• Атом (и всякая атомная система) может находиться не во всех
состояниях, допускаемых классической механикой, а только в не-
которых избранных (квантовых) состояниях, характеризующихся
определенными значениями энергии. В этих состояниях атом не
излучает и не поглощает энергию.
• Переход из одного стационарного состояния в другое сопровож-
дается излучением или поглощением одного светового кванта с
Опыт Франка и Герца
В опытах использовалась трубка (рис. 6.9), заполненная
парами ртути при давлении р ≈ 1 мм рт. ст. и три
электрода: катод, сетка и анод.
Электроны ускорялись разностью потенциалов
U между катодом и сеткой. Эту разность потенциалов
можно было изменять с помощью потенциометра П.
Между сеткой и анодом тормозящее поле 0,5 В (метод з
адерживающих потенциалов).
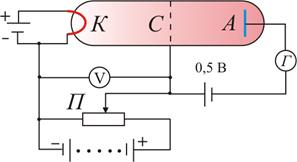
Определялась зависимость тока через гальванометр Г
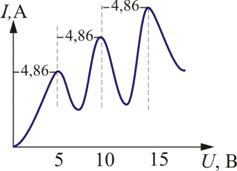
от разности потенциалов между катодом и сеткой U. В
эксперименте была получена зависимость, изображенная н
а рис. 6.10. ЗдесьU = 4,86 В – соответствует первому потенциалу возбуждения.
Согласно боровской теории, каждый из атомов ртути
может получить лишь вполне определенную энергию,
переходя в одно из возбужденных состояний.
Поэтому если в атомах действительно существуют
стационарные состояния, то электроны, сталкиваясь
с атомами ртути, должны терять энергию дискретно,
определенными порциями, равными разности энергии с
оответствующих стационарных состояний атома.
Из опыта следует, что при увеличении ускоряющего
потенциала вплоть до 4,86 В анодный ток возрастает
монотонно, его значение проходит через максимум (4,86 В),
затем резко уменьшается и возрастает вновь.
Таким образом, опыт показал, что электроны передают свою
энергию атомам ртути порциями, причем 4,86 эВ – наименьшая
возможная порция, которая может быть поглощена атомом
ртути в основном энергетическом состоянии. Следовательно,
идея Бора о существовании в атомах стационарных состояний
блестяще выдержала проверку экспериментом.
Теория водородоподобного атома:
электроны в атоме, двигаясь по
круговым орбитам, принимают не только дискретные значения энергии,
но и дискретные значения момента импульса.
Ридберг
получил эмпирическую формулу для частот
спектральных линий:
![]() Для
серии Бальмера m = 2, n = 3, 4, 5, ... . Для
ультрафиолетовой серии (
Для
серии Бальмера m = 2, n = 3, 4, 5, ... . Для
ультрафиолетовой серии (
серия Лаймана) m = 1, n = 2, 3, 4, ... . постоянная Ридберга R = 3,29·1015 Гц.
Для
круговых орбит правило квантования
Бора записывается в виде
![]() Здесь
me –
масса электрона, υ – его скорость, rn –
радиус стационарной
Здесь
me –
масса электрона, υ – его скорость, rn –
радиус стационарной
круговой орбиты. Правило квантования Бора позволяет вычислить радиусы
стационарных орбит электрона в атоме водорода и определить значения энергий.
Скорость электрона, вращающегося по круговой орбите некоторого радиуса
r в кулоновском поле ядра, как следует из второго закона Ньютона,
определяется
соотношением
![]() где
e – элементарный заряд, ε0 –
электрическая постоянная.
где
e – элементарный заряд, ε0 –
электрическая постоянная.
Скорость электрона υ и радиус стационарной орбиты rn связаны правилом
квантования Бора. Отсюда следует, что радиусы стационарных круговых о
рбит
определяются выражением
![]()
Ep < 0, так как между электроном и ядром действуют силы притяжения.
Подставляя
в эту формулу выражения для υ2 и
rn,
получим:
![]() Согласно
второму постулату Бора, при переходе
электрона с одной с
Согласно
второму постулату Бора, при переходе
электрона с одной с
тационарной орбиты с энергией En на другую стационарную орбиту с энергией
Em <
Enатом
испускает квант света, частота νnm которого
равна ΔEnm /
h:
![]()
