- •Лекция 2
- •1.8. Термодинамический процесс
- •2.1.Теплоёмкость идеальных газов
- •Изохорная теплоёмкость
- •Изобарная теплоемкость
- •2.2. Истинная и средняя теплоёмкости.
- •Смеси идеальных газов
- •3. Первый закон термодинамики
- •3.1. Закон сохранения и превращения энергии
- •3.2. Работа газа в процессе
- •3.3 Внутренняя энергия рабочего тела
- •3. 4. Математическое выражение первого закона термодинамики
- •3.5. Энтальпия
- •3.6. Энтропия
- •3.7. Тепловая t-s диаграмма
Изобарная теплоемкость
В процессе v = const теплота, сообщаемая газу, идет лишь на изменение его внутренней энергии, тогда как в процессе р = const теплота расходуется и на увеличение внутренней энергии и на совершение работы против внешних сил. Поэтому ср больше cv на величину этой работы. Из уравнения (4') при р = const имеем:
δqp = (ди/ дТ)V · dTp + [ р + (ди / дυ)т ] • dυ P (9)
Изобарная теплоёмкость ср равна отношению количество теплоты δqp в процессе при р = const к изменению температуры тела dТp
ср = δqp/dTp (10) Учитывая выражение (9) можно записать:
Ср = (ди/ дТ)v + [ р + (ди / дυ)т ] • (дυ/dT)р
Используя уравнение (6’) запишем:
cp = cv + [ р + (ди / дυ)т ] • (дυ/dT)р (11)
Для идеального газа. (дu / дv)T= 0, а так как R = р · v I T, то дифференцируя его при р = const, имеем:
R = p · (dυ/dT)p, (12)
Подставляя (12) в (11) имеем окончательно:
ср = cv + R (13) Выражение (13) носит название уравнения Майера. Для реальных газов
ср - cv > R, так как при расширении (при р = const) совершается не только внешняя, но и внутренняя работа, связанная с изменением внутренней потенциальной энергией газа, что вызывает больший расход теплоты.
Соотношение между теплоёмкостями определяется равенством
cр = cv + R . (13)
Выражение (13) носит название уравнения Майера. Роберт Ю. Майер был вюртембергским врачом, открытие им уравнения (13) (или принципа эквивалентности) относится к 1842 году.
В термодинамике часто используется отношение теплоёмкостей:
ср / cv = сp’/сv’= (µcp)/(µcv) = k; k = cp/cv = (cv + R)/cv = 1+R/cv, где k - показатель адиабаты.
Для идеальных газов k зависит от температуры. Методом статистической термодинамики установлено, что одноатомные газы имеют k = 1,66, двухатомные k = 1,4, трёхатомные к = 1,33, перегретый водяной пар к = 1,3.
2.2. Истинная и средняя теплоёмкости.
Теплоемкость реального газа очень слабо зависит давления. Поскольку теплоемкость реального газа, в основном, зависит от температуры, в термодинамике различают истинную и среднюю теплоемкости.
Для уяснения методики определения средней теплоемкости по указанным таблицам воспользуемся рис. 2. Истинной теплоёмкости соответствует кривая 3, определяемая зависимостью c = f(t). Заштрихованная под ней площадь эквивалентна количеству теплоты q, необходимому для нагревания 1 кг рабочего тела от температуры t1 до t2 :
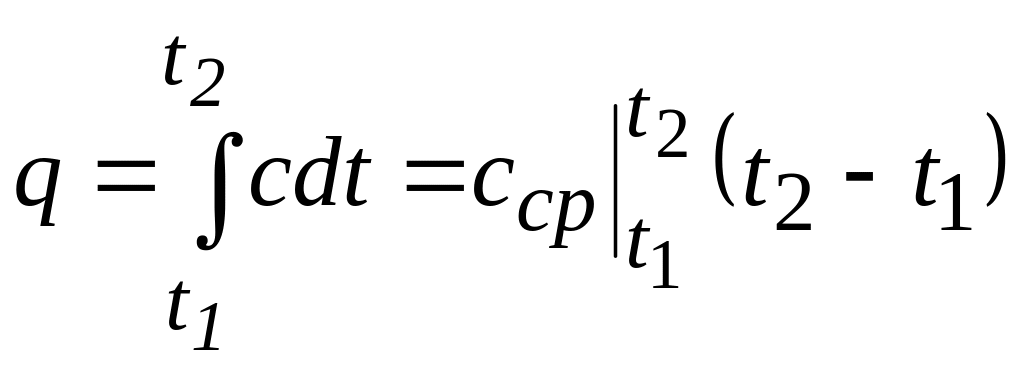 .
.
Ее
можно заменить равновеликим прямоугольником
с основанием t2
-
t1
и
высотой, численно равной средней
теплоемкости.
Обозначается
средняя теплоёмкость символом
![]() .
.
|
Рис. 2. Зависимость истинной теплоемкости от температуры |
![]() .
.
Для
практических расчётов теплоемкости
всех веществ сводят в таблицы, причем
с целью сокращения объема таблиц
средние теплоемкости
![]() приводят
в них для интервала температур от 0 0С
до t
0С
.
приводят
в них для интервала температур от 0 0С
до t
0С
.
Если необходимо с помощью таблиц определить среднюю теплоёмкость в интервале t2 - t1, то
![]() .
.
Все изложенное относится к массовым, мольным и объемным теплоемкостям.