- •Лекция 2
- •1.8. Термодинамический процесс
- •2.1.Теплоёмкость идеальных газов
- •Изохорная теплоёмкость
- •Изобарная теплоемкость
- •2.2. Истинная и средняя теплоёмкости.
- •Смеси идеальных газов
- •3. Первый закон термодинамики
- •3.1. Закон сохранения и превращения энергии
- •3.2. Работа газа в процессе
- •3.3 Внутренняя энергия рабочего тела
- •3. 4. Математическое выражение первого закона термодинамики
- •3.5. Энтальпия
- •3.6. Энтропия
- •3.7. Тепловая t-s диаграмма
Лекция 2
1.8. Термодинамический процесс
Термодинамическая система может произвести полезную работу только при условии, если в ней осуществляется термодинамический процесс. В этом случае изменяются и основные термодинамические параметры Р, v и Т. Термодинамический процесс - это совокупность изменений состояний термодинамической системы при её переходе из одного состояния в другое.
Мы будем рассматривать только равновесные термодинамические процессы, протекающие в равновесных системах. Равновесным состоянием системы называется состояние, когда во всех точках системы давления и температуры одинаковы. Система, выведенная из состояния равновесия и предоставленная при постоянных параметрах окружающей среды самой себе, через некоторое время вновь придет в равновесное состояние, соответствующее этим параметрам. Процесс, проходящий через чередующиеся равновесные состояния системы называется равновесным процессом.
В противном случае система неравновесна. Все процессы, протекающие в реальном времени, как правило, неравновесны. Допущение о существовании равновесных систем основано на том, что любая система, выведенная из состояния равновесия и предоставленная при постоянных параметрах окружающей среды самой себе, через некоторое время вновь придет в равновесное состояние. Такое самопроизвольное (без внешнего воздействия) возвращение системы в состояние равновесия называется релаксацией, а промежуток времени, в течение которого реальная система возвращается в состояние равновесия, называется временем релаксации. Если реальный процесс протекает медленнее, чем идёт релаксация, то процесс является равновесным. Дли разных процессов и разных параметров время релаксации различно. Внутренними процессами, компенсирующими нарушение равновесия при изменение состояния тела и восстанавливающими термодинамическое равновесие, являются элементарные процессы обмена энергией при столкновении молекул.
Интересно отметить, что превращение энергии поступательного движения молекул в энергию вращательного движения и обратно при столкновении молекул происходит весьма быстро. Так, давление в объёме выравнивается со скоростью звука (более 340 м/с в воздухе при нормальных физических условиях). Температура – значительно медленнее. Связано это с тем, что превращение энергии поступательного или вращательного движения молекул в колебательное при росте температуры осуществляется сравнительно медленно. Вообще все процессы обмена энергии, в которых участвуют колебательные степени свободы движения молекул, требуют для своего осуществления сравнительно большого времени.
Рассмотрим, например, процесс сжатия газа в цилиндре. Если время смещения поршня от одного положения до другого существенно превышает время релаксации, то в процессе перемещения поршня давление и температура успеют выровняться по всему объему цилиндра. Это выравнивание обеспечивается непрерывным столкновением молекул, в результате чего подводимая от поршня к газу энергия достаточно быстро и равномерно распределяется между ними. Если последующие смещения поршня будут происходить аналогичным образом, то состояние системы в каждый момент времени будет практически равновесным.
Теоретически равновесный процесс можно осуществить только при бесконечно медленном изменении состояний системы и внешних условий. В этом смысле время как действующий физический фактор в равновесных процессах не применяется.
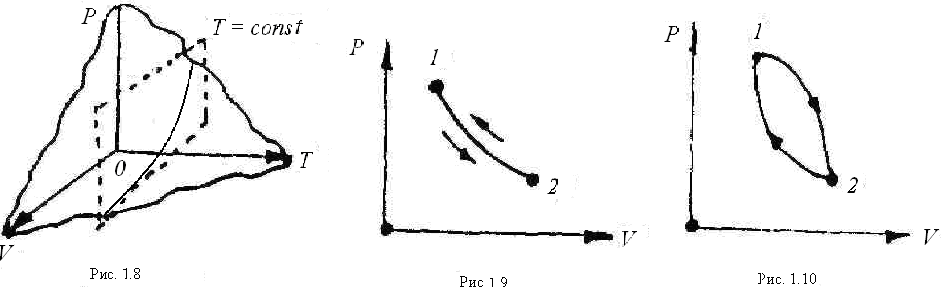
Уравнение состояния F (Р, v, Т) = 0 в трёхосной системе координат Р, v и Т представляют собой поверхность, называемую термодинамической поверхностью. Если рассечь эту поверхность (рис. 1.8) плоскостями параллельными осям координат, то получим кривые. Например, сечение плоскостью Т = const даёт линию изменения давления в зависимости от объёма в координатах Р и v, Описываемый процесс называется изотермным. В термодинамике чаще всего применяют двухосную систему с координатами Р и v (рис. 1.9).
|
Процесс может быть прямым и обратным. Если система с параметрами Р1 и v1 (точка 1) переходит в состояние 2 с параметрами Р2 и v2, а затем возвращается в состояние 1, то такой процесс называется обратимым (рис. 1.9). Обратимым называется равновесный процесс, проходящий в прямом и обратном направлениях через ряд одинаковых состояний. В обратной последовательности состояний равновесного процесса рабочее тело и внешняя среда возвращаются в исходное состояние.
Процессы, не соответствующие этому условию, называются необратимыми. Все реальные процессы необратимы.
В начальном курсе термодинамики рассматриваются равновесные обратимые процессы, происходящие в закрытых (ΔМ = 0) системах:
1) изохорный, протекающий при неизменном объеме (v = const);
2) изобарный, протекающий при неизменном давлении (p = const);
3) изотермный, протекающий при неизменной температуре (Т = const);
4) адиабатный, совершающийся при отсутствии теплообмена (ΔQ =0);
5) политропный, обобщающий, процесс, частными случаями котоpoгo являются первые четыре процесса.
Особое значение имеют замкнутые процессы (или круговые). Это такие процессы, при которых система проходит ряд последовательных состояний, возвращаясь к первоначальному. Иначе такой процесс называется циклом (рис. 1.10).