
- •39. Принцип работы гальванического элемента.
- •34. Межмолекулярные взаимодействия.
- •33. Водородная связь.
- •32. Металлическая связь.
- •31. Донорно-акцеторная связь.
- •30. Ионная связь.
- •29. Характеристика и форма электронных орбиталей.
- •28. Ковалентная связь.
- •27. Энергия ионизации. Сродство атома к электрону. Электроотрицательность.
- •Сродство атома к электрону
- •26. Квантовая ячейка. Электронная пара. Принцип Паули
- •Строение атомов и принцип Паули
- •25. Магнитное и спиновое квантовые числа.
- •24. Главное и орбитальное квантовые числа
26. Квантовая ячейка. Электронная пара. Принцип Паули
Графически электронные конфигурации принято отображать квантовыми ячейками, например электронная конфигурация атома кислорода изображается тремя квантовыми ячейками (рисунок 1). Здесь клеткой обозначается орбиталь, стрелкой – электрон (направление стрелки указывает ориентацию спина электрона), пустая клетка соответствует свободной орбитали.
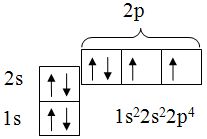
Рисунок 1 – Квантовые ячейки атома кислорода
Такими ячейками отображают строение верхних слоев атома, здесь положение квантовой ячейки 2p показывает, что энергия заполнения электронами орбитали 2p выше, чем для орбитали 2s, т.е. электроны сначала заполняют ячейку 2s, а затем 2p.
При построении таблицы изменим слегка традиционное представление квантовых ячеек (рисунок 2):
1) для каждого электрона отведем свою квантовую ячейку (здесь учитывается принцип Паули);
2) будем считать что большей энергией обладают ячейки находящиеся выше и правее.
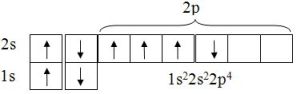
Рисунок 2 – Квантовые ячейки атома кислорода (одна ячейка на электрон)
Электронная пара — связанное состояние двух взаимодействующих электронов. Обладает нулевым спином и зарядом, равным удвоенному заряду электрона.
Различают поделённые (связывающие) электронные пары, принимающие участие в образовании химической связи за счёт взаимодействия неспаренных электронов, и неподелённые электронные пары (внешние электронные пары), не принимающие участие в образовании химической связи. Различают также свободные (подвижные) электронные пары (куперовские пары), обладающие большой свободой движения в кристаллической решётке, образуемой положительными ионами металла.
Считается, что термин «электронная пара» ввёл американский физикохимик Льюис в процессе разработки электронной теории химической связи.
Льюис подчеркнул важность явлений спаривания как общих, так и неподелённых электронов и стабильность группы из восьми электронов (октетная теория): «химической связью всегда и во всех молекулах является только пара электронов, соединяющих два атома.»
При́нцип Па́ули (принцип запрета) — один из фундаментальных принципов квантовой механики, согласно которому два и более тождественных фермиона (частиц с полуцелым спином) не могут одновременно находиться в одном квантовом состоянии.
Принцип был сформулирован для электронов Вольфгангом Паули в 1925 г. в процессе работы над квантомеханической интерпретацией аномального эффекта Зеемана и в дальнейшем распространён на все частицы с полуцелым спином. Полное обобщённое доказательство принципа было сделано им в теореме Паули (теореме о связи спина со статистикой) в 1940 г. в рамках квантовой теории поля. Из этой теоремы следовало, чтоволновая функция системы фермионов является антисимметричной относительно их перестановок, поведение систем таких частиц описывается статистикой Ферми — Дирака.
Принцип Паули можно сформулировать следующим образом: в пределах одной квантовой системы в данном квантовом состоянии может находиться только одна частица, состояние другой должно отличаться хотя бы одним квантовым числом.
В
статистической физике принцип Паули
иногда формулируется в терминах чисел
заполнения:
в системе одинаковых частиц, описываемых
антисимметричной волновой функцией,
числа заполнения могут принимать лишь
два значения ![]()
