- •39. Принцип работы гальванического элемента.
- •34. Межмолекулярные взаимодействия.
- •33. Водородная связь.
- •32. Металлическая связь.
- •31. Донорно-акцеторная связь.
- •30. Ионная связь.
- •29. Характеристика и форма электронных орбиталей.
- •28. Ковалентная связь.
- •27. Энергия ионизации. Сродство атома к электрону. Электроотрицательность.
- •Сродство атома к электрону
- •26. Квантовая ячейка. Электронная пара. Принцип Паули
- •Строение атомов и принцип Паули
- •25. Магнитное и спиновое квантовые числа.
- •24. Главное и орбитальное квантовые числа
29. Характеристика и форма электронных орбиталей.
Орбиталь – пространство вокруг ядра, в котором наиболее вероятно нахождение электрона. Применительно к электрону можно сказать, что он ведет себя и как частица, и как волна, т. е. обладает, как и другие микрочастицы, корпускулярно-волновым дуализмом (двойственностью). С одной стороны, электроны как частицы производят давление, с другой стороны, движущийся поток электронов обнаруживает волновые явления, например дифракцию электронов. Дифракция – способность волн огибать препятствия, размеры которых соизмеримы с длиной волны. Атомные орбитали отличаются энергией, размером, формой и положением в пространстве относительно ядра. Согласно квантово-механическим расчетам s-орбитали имеют форму шара (рис. 1), p-орбитали – форму гантели (рис. 2). d-Орбиталь в зависимости от характеризующих ее квантовых чисел может принимать две различные формы (рис. 3), а f-орбиталь – четыре различные формы (рис. 4).
|
|
Рис. 1. Форма s-орбитали
|
|
|
|
Рис. 2. Форма p-орбитали
|
|
|
|
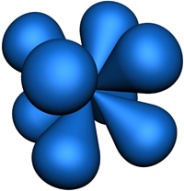
Рис. 3. Возможные формы d-орбиталей
|
|
|
|
|
|
Рис. 4. Возможные формы f-орбиталей |
|
Орбиталь можно описать с помощью набора квантовых чисел: n – главное квантовое число, l – орбитальное квантовое число, ml – магнитное квантовое число, ms – спиновое квантовое число.
28. Ковалентная связь.
Ковалентной называется химическая связь, осуществляемая электронными парами. Соединения с ковалентной связью называют гомеополярными или атомными.
Существуют две разновидности ковалентной связи: полярная и неполярная.
При неполярной ковалентной связи образованное общей парой электронов электронное облако распределяется симметрично относительно ядер обоих атомов. В качестве примера могут выступать двухатомне молекулы, которые состоят из одного элемента: Cl2, N2, H2, F2, O2 и другие, электронная пара в которых в принадлежит обоим атомам в одинаковой мере.
При полярной ковалентной связи электронное облако смещено к атому с большей относительной электроотрицательностью. Например молекулы летучих неорганических соединений таких как H2S, HCl, H2O и другие.
Образование молекулы HCl можно представить в следущем виде:
![]()
Т.к. относительная электроотрицательность атома хлора (2,83) больше, чем атома водорода (2,1), электронная пара смещается к атому хлора.
Помимо
обменного механизма образования
ковалентной связи – за счет перекрывания,
также существует донорно-акцепторный механизм
ее образования. Это механизм, при котором
образование ковалентной связи происходит
за счет двухэлектронного облака одного
атома (донора) и свободной орбитали
другого атома (акцептора). Давайте
рассмотрим пример механизма образования
аммония NH4+.В
молекуле аммиака у атома азота есть
двухэлектронное облако:![]()
Ион
водорода имеет свободную 1s-орбиталь,
обозначим это как ![]() .
.
В
процессе образования иона аммония
двухэлектронное облако азота становится
общим для атомов азота и водорода, это
значит оно преобразуется в молекулярное
электронное облако. Следовательно,
появляется четвертая ковалентная связь.
Можно представить процесс образования
аммония такой схемой: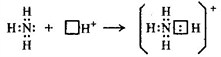
Заряд иона водорода рассредоточен между всеми атомами, а двухэлектронное облако, которое принадлежит азоту, становится общим с водородом.