
- •39. Принцип работы гальванического элемента.
- •34. Межмолекулярные взаимодействия.
- •33. Водородная связь.
- •32. Металлическая связь.
- •31. Донорно-акцеторная связь.
- •30. Ионная связь.
- •29. Характеристика и форма электронных орбиталей.
- •28. Ковалентная связь.
- •27. Энергия ионизации. Сродство атома к электрону. Электроотрицательность.
- •Сродство атома к электрону
- •26. Квантовая ячейка. Электронная пара. Принцип Паули
- •Строение атомов и принцип Паули
- •25. Магнитное и спиновое квантовые числа.
- •24. Главное и орбитальное квантовые числа
39. Принцип работы гальванического элемента.
Принцип действия гальванического элемента. В два стакана наливают до половины 1 М раствора сульфата меди и сульфата цинка. В первый стакан погружают медную пластинку, во второй ‒ цинковую (рис.). Растворы в стаканах соединяют U-образной трубкой, заполненной электролитом - раствором хлорида калия, основой которого является 5-процентный раствор агар-агара.
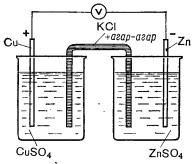
Рис. Схема медно-цинкового гальванического элемента
U-образная трубка (сифон) является соединительным мостиком для того, чтобы ионы могли свободно перемещаться из раствора одного стакана в другой.
Свободные концы проводников от электродов присоединяют к гальванометра, указывающий на появление электрического тока в гальваническом ночном элементе.
Э. д. с. (Электродвижущую силу) элемента можно определить с помощью вольтметра или рассчитать, пользуясь таблицей нормальных электродных потенциалов.
Zn | Zn2+ — 76 В; Сu | Сu2+ = +34 В;
ЭДС = +0,34 В ‒ ( ‒ 0,76 В) =1,1 В.
Полученная Э. д. с. гальванического элемента может значительно отличаться от действительной. Точность измерения зависит от сопротивления вольтметра, диаметра U-образной трубки. Чем больше диаметр трубки, тем точнее результат. Отметим, что для точного измерения Э. д. с. лучше использовать компенсационные схемы, в частности приборы, основанные на этой схеме, ‒ потенциометры.
Приготовление раствора электролита для U-образной трубки: 5 г агар-агара растворяют в 95 г воды при нагревании. В растворе агар-агара растворяют 25 г хлорида калия.
Реактивы и оборудование: сульфат меди СuSO4, сульфат цинка ZnSO4, хлорид калия КС1, агар-агар, 2 стакана на 250 мл, цинковая и медная пластинки (12 см×2 см) с припаянными проводниками, вольтметр, U-образная стеклянная трубка диаметром 5 -7 мм.
34. Межмолекулярные взаимодействия.
Межмолекулярные взаимодействия, взаимодействия молекул между собой, не приводящее к разрыву или образованию новых химических связей. Межмолекулярные взаимодействия определяют отличие реальных газов от идеальных, существование жидкостей и молекулярных кристаллов. От межмолекулярных взаимодействий зависят многие структурные, спектральные, термодинамические, теплофизические и другие свойства веществ. Появление понятия межмолекулярные взаимодействия связано с именем Й. Д. Ван-дер-Ваальса, который для объяснения свойств реальных газов и жидкостей предложил в 1873 уравнение состояния, учитывающее межмолекулярные взаимодействия. Поэтому силы межмолекулярного взаимодействия часто называют ван-дер-ваальсовыми.
Виды межмолекулярных взаимодействий. Основу межмолекулярных взаимодействий составляют кулоновские силы взаимодействия между электронами и ядрами одной молекулы и ядрами и электронами другой. В экспериментально определяемых свойствах вещества проявляется усредненное взаимодействие, которое зависит от расстояния R между молекулами, их взаимной ориентации, строения и физических характеристик (дипольного момента, поляризуемости и др.). При больших R, значительно превосходящих линейные размеры l самих молекул, вследствие чего электронные оболочки молекул не перекрываются, силы межмолекулярного взаимодействия можно достаточно обоснованно подразделить на три вида - электростатические, поляризационные (индукционные) и дисперсионные. Электростатические силы иногда называют ориентационными, однако это неточно, поскольку взаимная ориентация молекул может обусловливаться также и поляризационными силами, если молекулы анизотропны.
При малых расстояниях между молекулами (R ~ l) различать отдельные виды межмолекулярных взаимодействий можно лишь приближенно, при этом, помимо названных трех видов, выделяют еще два, связанные с перекрыванием электронных оболочек, - обменное взаимодействие и взаимодействия, обязанные переносу электронного заряда. Несмотря на некоторую условность, такое деление в каждом конкретном случае позволяет объяснять природу межмолекулярного взаимодействия и рассчитать его энергию.
