
- •[Править]Роль в организме
- •[Править]Пути синтеза
- •[Править]Протеинкиназа а
- •[Править]цAmф как вторичный посредник в сигнальной трансдукции
- •Вторичная структура рнк
- •[Править]Участвующие в трансляции
- •[Править]Участвующие в регуляции генов
- •[Править]в процессинге рнк
- •История исследований рибосомы
- •[Править]Механизм трансляции
- •«15» Свойства генетического кода
- •«16» Трансляция (биология)
- •[Править]Механизм
- •[Править]Рамка считывания
- •[Править]Инициация
- •[Править]у прокариот
- •[Править]у эукариот
- •[Править]Кэп-зависимый механизм
- •[Править]Диссоциация и антиассоциация субъединиц рибосом
- •[Править]Cелекция инициаторной метионил-тРнк (Met-tRnAiMet)
- •[Править]Элонгация
- •[Править]Терминация
- •[Править]Компартментализация у эукариот
- •[Править]Примечания «18» Причины мутаций
- •[Править]Связь мутаций с репликацией днк
- •[Править]Связь мутаций с рекомбинацией днк
- •[Править]Связь мутаций с репарацией днк
- •[Править]Классификации мутаций
- •[Править]Последствия мутаций для клетки и организма
- •[Править]Роль мутаций в эволюции
История исследований рибосомы
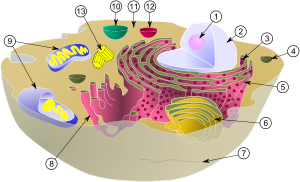
Схема, показывающая цитоплазму, вместе с её компонентами (или органеллами), в типичной животной клетке. Органеллы: (1) Ядрышко (2) Ядро (3) рибосома (маленькие точки) (4) Везикула (5) шероховатый эндоплазматический ретикулум (ER) (6) Аппарат Гольджи (7) Цитоскелет (8) Гладкий эндоплазматический ретикулум (9) Митохондрия (10) Вакуоль (11) Цитоплазма (12) Лизосома (13) Центриоль и Центросома
Рибосомы впервые были описаны как уплотненные частицы, или гранулы, клеточным биологом румынского происхождения Джорджем Паладе в середине 1950-х годов[1]. В 1974 г. Паладе, Клод и Кристиан Де Дюв получили Нобелевскую премию по физиологии и медицине «за открытия, касающиеся структурной и функциональной организации клетки». Термин «рибосома» был предложен Ричардом Робертсом в 1958 вместо «рибонуклеобелковая частица микросомальной фракции»[2]. Биохимические и мутационные исследования рибосомы начиная с 1960-х позволили описать многие функциональные и структурные особенности рибосомы.
В начале 2000-х появились атомные структуры отдельных субъединиц, а также полной рибосомы, связанной с различными субстратами, которые позволили понять механизм декодинга(распознавания антикодона тРНК, комплементарного кодону мРНК) и детали взаимодействий между рибосомой, антибиотиками, тРНК и мРНК.
Нобелевская премия по химии 2009 года получена за определение структуры прокариотической рибосомы учёным из Великобритании Венкатраманом Рамакришнаном, американцем Томасом Стейцем и израильтянкой Адой Йонат. В 2010 году в лаборатории Марата Юсупова была определена трехмерная структура эукариотической рибосомы.[3]
В 2009 году канадские биохимики Константин Боков и Сергей Штейнберг из Монреальского университета, исследовав трёхмерную структуру рибосомной РНК современных бактерий E.coli, пришли к выводу, что рибосомы могли сформироваться в результате постепенной эволюции из очень простой маленькой молекулы РНК — «проторибосомы», способной катализировать реакцию соединения двух аминокислот. Все остальные структурные блоки рибосомы последовательно добавлялись к проторибосоме, не нарушая её структуру и постепенно повышая эффективность её работы.[4]
[Править]Механизм трансляции
Трансляция — синтез белка рибосомой на основе информации, записанной в матричной РНК (мРНК). мРНК связывается с малой субъединицей рибосомы, когда происходит узнавание 3'-концом 16S рибосомной РНК комплементарной последовательностиШайн-Далгарно, расположенной на 5'-конце мРНК (у прокариот), а также позиционирование стартового кодона (как правило, AUG) мРНК на малой субъединице. У эукариот малая субчастица рибосомы связывается также с помощью кэпа, на конце мРНК. Ассоциация малой и большой субъединиц происходит при связывании формилметионил-тРНК (fMET-тРНК) и участии факторов инициации (IF1, IF2 и IF3 у прокариот; их аналоги и дополнительные факторы участвуют в инициации трансляции у эукариотических рибосом). Таким образом, распознавание антикодона (в тРНК) происходит на малой субъединице.
После ассоциации, fMET-тРНК находится в P- (peptidyl-) сайте каталитического(пептидил-трансферазного) центра рибосомы. Следующая тРНК, несущая на 3'-конце аминокислоту и комплементарная второму кодону на мРНК, помещается с помощью фактора EF-Tu в А- (aminoacyl-) сайт каталитического центра рибосомы. Затем, образуется пептидная связь между формилметионином (связанным с тРНК, находящейся в Р-сайте) и аминокислотой, принесенной тРНК, находящейся в А-сайте. Механизм катализа образования пептидной связи в пептидил-трансферазном центре до сих пор полностью не ясен. На данный момент существует несколько гипотез, объясняющих детали этого процесса: 1. Оптимальное позиционирование субстратов (induced fit)[5], 2. Исключение из активного центра воды, способной прервать образование пептидной цепи посредством гидролиза[6], 3. Участие нуклеотидов рРНК (таких как А2450 и А2451) в переносе протона[7][8], 4. Участие 2'-гидроксильной группы 3'-концевого нуклеотида тРНК (А76) в переносе протона[9];. Высокая эффективность катализа достигается взаимодействием этих факторов.
После образования пептидной связи, полипептид оказывается связанным с тРНК, находящейся в А-сайте. На следующем этапе деацилированная тРНК двигается из Р-сайта в Е-сайт (exit-), а пептидил-тРНК из А- в Р-сайт. Этот процесс называется транслокацией и происходит при участии фактора EF-G. тРНК, комплементарная следующему кодону мРНК, связывается с А-центром рибосомы, что ведет к повторению описанных шагов. Стоп-кодоны (UGA, UAG и UAA) сигнализируют об окончании трансляции. Процесс окончания трансляции и освобождения готового полипетида, рибосомы и мРНК, называется терминацией. У прокариот он происходит при участии факторов терминации RF1, RF2, RF3 и RRF.
