
- •Лекция 6.
- •Глава 3. Основы молекулярной физики и термодинамики.
- •§1.Основные понятия.
- •Внешние.
- •Внутренние.
- •§2.Законы идеальных газов.
- •Р Дано: , , , ешение:
- •Р Дано: ешение:
- •Р Дано: , , , , , ешение:
- •Р Дано: , , ешение:
- •§3.Молекулярно-кинетическая теория газов.
- •Распределение частиц во внешних полях.
- •Опытное обоснование молекулярно-кинетической теории.
- •Р Дано: , , , , ешение:
- •Р Дано: ешение:
- •Р Дано: , , ешение:
- •Лекции 7-8.
- •§4.Физические основы термодинамики. Внутренняя энергия системы.
- •Теплообмен. Явления переноса.
- •Вакуум и методы его получения.
- •Работа.
- •Первый закон термодинамики.
- •Р Дано: , , ешение:
- •Решение:
- •Обратимые и необратимые процессы.
- •Энтропия.
- •Круговые процессы. Цикл Карно.
- •Второй закон термодинамики.
- •Третий закон.
- •Р Дано: , , , , ешение:
- •Р Дано: , , , ешение:
- •Решение:
- •Решение:
- •Решение:
- •§5.Реальные газы. Жидкости. Реальные газы.
- •Изотермы реальных газов.
- •Решение:
- •Решение:
- •Решение:
- •Решение:
- •Решение:
Р Дано: , , , ешение:
Д ля
начального состояния уравнение Менделеева
- Клапейрона имеет вид:
ля
начального состояния уравнение Менделеева
- Клапейрона имеет вид:
![]() .
Т.к. объем гелия в конечном состоянии
будет таким же (ограничен объемом
сосуда), то
.
Т.к. объем гелия в конечном состоянии
будет таким же (ограничен объемом
сосуда), то
![]() .
Т.к.
.
Т.к.
![]() ,
то из данных уравнений найдем массы:
,
то из данных уравнений найдем массы:
![]() и
и
![]() ,
получим
,
получим
![]()
![]() .
.
![]()
![]()
![]()
Ответ:
![]() .
.
Пример 3.2.2. Найти массу киломоля смеси 25 г кислорода и 75 г азота.
Р Дано: ешение:
![]()
 ,
где масса смеси равна сумме компонент
смеси:
,
где масса смеси равна сумме компонент
смеси:
![]() .
Число киломолей смеси равно сумме
киломолей отдельных газов:
.
Число киломолей смеси равно сумме
киломолей отдельных газов:
![]() ,
т.к.
,
т.к.
![]() ,
,
![]() ,
то
,
то
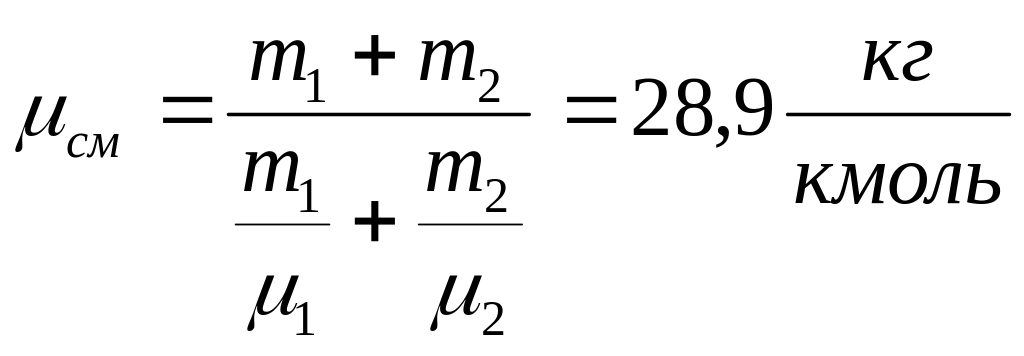
Ответ:
![]()
Пример 3.2.3. Определить: 1) сколько молекул содержится в 1 мм3 воды? 2) какова масса молекулы воды? 3) считая условно, что молекулы воды имеют вид шариков, соприкасающихся друг с другом, найти диаметр молекул.
1.![]() .Т.к.
.Т.к.![]() ,
,
![]() ,
то
,
то![]() молекул.
молекул.
2.
Масса одной молекулы:
![]() .
.
3.
Если молекулы плотно прилегают друг к
другу, то можно считать, что на каждую
молекулу приходится объем (кубическая
ячейка):
![]() ,
где
,
где
![]() диаметр
молекулы. Если разделить объем одного
киломоля вещества на число молекул в
киломоле (число Авогадро), то
диаметр
молекулы. Если разделить объем одного
киломоля вещества на число молекул в
киломоле (число Авогадро), то
![]() и
и
![]() .
.
Пример 3.2.4. Какое количество кислорода выпустили из баллона емкостью 10 л, если при этом показания манометра на баллоне изменились от 14 до 17 ат, а температура понизилась от 270С до 70С?
Р Дано: , , , , , ешение:
М асса
выпущенного из баллона газа
асса
выпущенного из баллона газа
![]() равна разности между начальной массой
кислорода в баллоне и его конечной
массой
равна разности между начальной массой
кислорода в баллоне и его конечной
массой
![]() .
Т.к. условия в баллоне не слишком
отличаются от нормальных, газ можно
считать идеальным. Для начального и
конечного состояний газа в баллоне
получим
,
.
Т.к. условия в баллоне не слишком
отличаются от нормальных, газ можно
считать идеальным. Для начального и
конечного состояний газа в баллоне
получим
,
![]()
![]() .
.
Внимание:
чтобы найти
давление газа в баллоне, прибавим к
показателям манометра величину
атмосферного давления, равную 1 ат.
Выразим в единицах СИ числовые значения
величин:
![]() ,
,![]() ,
,
![]() ,
,
![]() ,
,
![]() ,
,
![]() ,
,
![]() .
Получаем
.
Получаем
![]() .
.
Ответ:
![]() .
.
Пример 3.2.5. Найти молярную массу воздуха, считая, что он состоит по массе из одной части кислорода и трех частей азота.
Р Дано: , , ешение:
С войствами
идеального газа могут обладать не только
химически однородные газы, но и газовые
смеси. Чтобы применить уравнение
состояния для
газовой
смеси,
ей
необходимо
приписать
некоторую, хотя и лишенную химического
смысла, относительную молекулярную
массу. Масса смеси в граммах, численно
равная ей, представляет собой молярную
массу
смеси. Величину
выбирают такой, чтобы она удовлетворяла
уравнению газового состояния, записанному
для смеси:
войствами
идеального газа могут обладать не только
химически однородные газы, но и газовые
смеси. Чтобы применить уравнение
состояния для
газовой
смеси,
ей
необходимо
приписать
некоторую, хотя и лишенную химического
смысла, относительную молекулярную
массу. Масса смеси в граммах, численно
равная ей, представляет собой молярную
массу
смеси. Величину
выбирают такой, чтобы она удовлетворяла
уравнению газового состояния, записанному
для смеси:
![]() .
Рассмотрим каждую из газовых компонент:
.
Рассмотрим каждую из газовых компонент:
![]() ,
,
![]() ,
где
,
где
![]() и
и
![]() парциальные
давления каждой компоненты. Для смеси
справедлив закон Дальтона:
парциальные
давления каждой компоненты. Для смеси
справедлив закон Дальтона:
![]() ,
откуда
,
откуда
![]() ,
а т.к.
,
а т.к.
![]() ,
то
,
то
![]() и
и
![]() .
Табличные значения
.
Табличные значения
![]() ,
,
![]() ,
получаем
,
получаем
![]() .
.
Ответ:
§3.Молекулярно-кинетическая теория газов.
Кинетическая теория газов основана на следующих общих положениях классической статистической физики:
в системе частиц выполняются законы сохранения импульса, момента импульса, энергии, электрического заряда (для систем заряженных частиц) и числа частиц (для закрытых систем, не претерпевающих химических и других превращений);
все частицы системы считаются «меченными», т.е. предполагается возможность отличать друг от друга тождественные частицы (например, молекулы одного и того же вещества);
все физические процессы в системе протекают в пространстве и времени непрерывно (например, энергия молекулы может изменяться под влиянием внешних воздействий на любую величину, т.е. непрерывно);
каждая частица системы может иметь совершенно произвольные значения координат (в пределах объема системы) и компонент скорости совершенно независимо от того, каковы значения этих характеристик у других частиц системы.
Важнейшей задачей кинетической теории газов является вычисление давления (макроскопическое проявление теплового движения молекул) идеального газа на основе молекулярно- кинетических представлений.
Сравнивая
уравнение состояния идеального газа и
основное уравнение кинетической теории
газов, записанные для одного моля
(3.2.6’) (для этого число молекул N возьмём
равным числу Авогадро NА),
найдём среднюю кинетическую энергию
одной молекулы:
![]() ,
(3.3.1.)
,
(3.3.1.)
или
давление, производимое газом, численно
равно
![]() средней кинетической энергии
поступательного движения молекул в
единице объема
(или
объемной плотности энергии поступательного
движения молекул):
средней кинетической энергии
поступательного движения молекул в
единице объема
(или
объемной плотности энергии поступательного
движения молекул):![]() -
(3.3.2.)
-
(3.3.2.)
основное
уравнение кинетической теории газов,
где
![]() число
молекул в единице объема,
число
молекул в единице объема,
![]() средняя
кинетическая энергия поступательного
движения одной молекулы.
средняя
кинетическая энергия поступательного
движения одной молекулы.
Т.о. давление химически однородного идеального газа зависит от массы и концентрации молекул, а также от скоростей их теплового движения.
Т.к.
![]() ,
то
,
то
![]() (3.3.3.)
(3.3.3.)
Средняя
кинетическая энергия поступательного
движения молекулы не зависит от её
природы и пропорциональна абсолютной
температуре газа T. Отсюда следует, что
абсолютная
температура является мерой средней
кинетической энергии молекул
(в области температур, далеких от
![]() ).
).
Так
как
![]() ,
то средняя квадратичная скорость равна
,
то средняя квадратичная скорость равна
![]() .
(3.3.4.)
.
(3.3.4.)
Средняя квадратичная скорость является одной из характеристик движения всей совокупности молекул. Она не имеет смысла для одной молекулы или небольшого их числа.
Подставляя
значение средней кинетической энергии
поступательного движения молекул в
основное уравнение молекулярно-кинетической
теории газов, получим другую форму
уравнения состояния идеального газа:![]() (3.2.6’.)
(3.2.6’.)
Основное
уравнение кинетической теории газов
Клаузиуса:
![]() ,
(3.3.5.)
,
(3.3.5.)
где
![]() .
Формулу можно применять для смеси газов.
.
Формулу можно применять для смеси газов.
Средняя
кинетическая энергия,
приходящаяся на одну степень свободы,
![]() .
(3.3.6.)
.
(3.3.6.)
Средняя
кинетическая энергия
(поступательного
и вращательного движений)
одной молекулы
![]() ,
(3.3.7.)
,
(3.3.7.)
где
![]() число степеней свободы.
число степеней свободы.
Число
![]() степеней свободы есть число независимых
координат, определяющих положение
молекулы в пространстве. В зависимости
от сложности строения молекулы
принимает следующие значения (если не
учитывать колебаний частей молекул):
степеней свободы есть число независимых
координат, определяющих положение
молекулы в пространстве. В зависимости
от сложности строения молекулы
принимает следующие значения (если не
учитывать колебаний частей молекул):
![]() для
одноатомных газов
(молекулу
одноатомного газа рассматривают как
материальную
точку,
которой
приписывают
три степени
свободы поступательного движения; при
этом энергию вращательного движения
не учитывают);
для
одноатомных газов
(молекулу
одноатомного газа рассматривают как
материальную
точку,
которой
приписывают
три степени
свободы поступательного движения; при
этом энергию вращательного движения
не учитывают);
![]() для
двухатомных газов
(молекулу
двухатомного газа рассматривают как
совокупность двух материальных точек,
жестко связанных недеформируемой
связью. Имеет три степени свободы
поступательного движения и две степени
вращательного движения. Вращение вокруг
третьей оси – проходящей через оба
атома - лишено смысла);
для
двухатомных газов
(молекулу
двухатомного газа рассматривают как
совокупность двух материальных точек,
жестко связанных недеформируемой
связью. Имеет три степени свободы
поступательного движения и две степени
вращательного движения. Вращение вокруг
третьей оси – проходящей через оба
атома - лишено смысла);
![]() для
трех- и многоатомных газов
(молекулу
трехатомного газа рассматривают как
совокупность трех материальных точек,
жестко связанных недеформируемой
связью. Имеет три степени свободы
поступательного движения и три степени
вращательного движения).
для
трех- и многоатомных газов
(молекулу
трехатомного газа рассматривают как
совокупность трех материальных точек,
жестко связанных недеформируемой
связью. Имеет три степени свободы
поступательного движения и три степени
вращательного движения).
