
- •Лекция 6.
- •Глава 3. Основы молекулярной физики и термодинамики.
- •§1.Основные понятия.
- •Внешние.
- •Внутренние.
- •§2.Законы идеальных газов.
- •Р Дано: , , , ешение:
- •Р Дано: ешение:
- •Р Дано: , , , , , ешение:
- •Р Дано: , , ешение:
- •§3.Молекулярно-кинетическая теория газов.
- •Распределение частиц во внешних полях.
- •Опытное обоснование молекулярно-кинетической теории.
- •Р Дано: , , , , ешение:
- •Р Дано: ешение:
- •Р Дано: , , ешение:
- •Лекции 7-8.
- •§4.Физические основы термодинамики. Внутренняя энергия системы.
- •Теплообмен. Явления переноса.
- •Вакуум и методы его получения.
- •Работа.
- •Первый закон термодинамики.
- •Р Дано: , , ешение:
- •Решение:
- •Обратимые и необратимые процессы.
- •Энтропия.
- •Круговые процессы. Цикл Карно.
- •Второй закон термодинамики.
- •Третий закон.
- •Р Дано: , , , , ешение:
- •Р Дано: , , , ешение:
- •Решение:
- •Решение:
- •Решение:
- •§5.Реальные газы. Жидкости. Реальные газы.
- •Изотермы реальных газов.
- •Решение:
- •Решение:
- •Решение:
- •Решение:
- •Решение:
§2.Законы идеальных газов.
Опр.3.2.1. Идеальным называется газ, молекулы которого
имеют пренебрежимо малый собственный объем,
не взаимодействуют друг с другом на расстоянии,
сталкиваются между собой и со стенками сосуда абсолютно упруго.
Т.е. идеальным газом называется газ, в котором отсутствуют силы межмолекулярного взаимодействия. С достаточной степенью точности газы можно считать идеальными в тех случаях, когда рассматриваются их состояния, далекие от областей фазовых превращений.
Н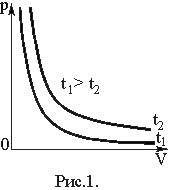 апр.,
при нормальных
условиях
(давление
апр.,
при нормальных
условиях
(давление
![]() и температуре
и температуре
![]() )
водород, гелий,
неон, азот, кислород, воздух и др. можно
считать с хорошим приближением идеальными.
)
водород, гелий,
неон, азот, кислород, воздух и др. можно
считать с хорошим приближением идеальными.
Для идеальных газов справедливы законы:
а)
Закон
Бойля-Мариотта.
При изотермическом
процессе![]() произведение объема данной массы газа
(масса неизменна) на давление есть
величина постоянная
произведение объема данной массы газа
(масса неизменна) на давление есть
величина постоянная
![]() .
(3.2.1.)
.
(3.2.1.)
Для
двух
состояний
газа
закон
записывается
в
виде![]() ,(3.2.1’.)
,(3.2.1’.)
где
![]() и
и
![]() давление
и объем газа в начальном состоянии,
давление
и объем газа в начальном состоянии,
![]() и
и
![]() давление
и объем газа в конечном состоянии.
давление
и объем газа в конечном состоянии.
Графически
этот закон в координатах
РV изображается
линией, называемой изотермой
(рис.1). Изотермы – гиперболы, расположенные
на графике тем выше, чем выше температура
процесса.
б)
Закон Дальтона.
Давление
меси различных газов равно сумме
парциальных давлений газов, составляющих
смесь:
![]() .
(3.2.2.)
.
(3.2.2.)
в)
Закон
Гей-Люссака.
При
изобарическом
процессе![]()
![]() .
(3.2.3.)
.
(3.2.3.)
( при
постоянном давлении объем данной массы
газа прямо пропорционален его абсолютной
температуре).
при
постоянном давлении объем данной массы
газа прямо пропорционален его абсолютной
температуре).
Для
двух состояний газа
![]() ,
(3.2.3’.)
,
(3.2.3’.)
где
![]() и
абсолютная
температура и объем газа в начальном
состоянии,
и
абсолютная
температура и объем газа в начальном
состоянии,
![]() и
абсолютная температура и объем газа в
конечном состоянии.
и
абсолютная температура и объем газа в
конечном состоянии.
Если
температура выражена по шкале Цельсия,
то
![]() ,
(3.2.3”.)
,
(3.2.3”.)
где
![]() температура по шкале Цельсия,
температура по шкале Цельсия,
![]() объем газа при температуре
объем газа при температуре
![]() ,
,
![]() объем газа при температуре
объем газа при температуре
![]() ,
,
![]() коэффициент
объемного расширения газов (для идеальных
газов
коэффициент
объемного расширения газов (для идеальных
газов
![]() ,
,
![]() ).
).
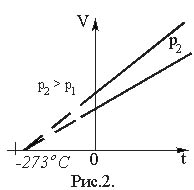
Г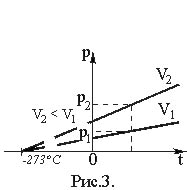 рафически
зависимость объема от температуры
изображается прямой линией – изобарой
(рис. 2). При очень низких температурах
(близких к –273°С) закон Гей-Люссака не
выполняется, поэтому сплошная линия на
графике заменена пунктиром.
рафически
зависимость объема от температуры
изображается прямой линией – изобарой
(рис. 2). При очень низких температурах
(близких к –273°С) закон Гей-Люссака не
выполняется, поэтому сплошная линия на
графике заменена пунктиром.
г)
Закон Шарля.
При изохорическом
процессе
![]()
![]() .
(3.2.4.)
.
(3.2.4.)
(при постоянном объеме давление данной массы газа прямо пропорционально его абсолютной температуре).
Для
двух состояний газа
![]() ,
(3.2.4’.)
,
(3.2.4’.)
где и -абсолютная температура и давление газа в начальном состоянии, и - абсолютная температура и давление газа в конечном состоянии.
Если
температура
выражена
по шкале Цельсия,
то
![]() ,(3.2.4”.)
,(3.2.4”.)
где
температура по шкале Цельсия,
![]() давление газа при температуре
,
давление газа при температуре
,
![]() давление газа при температуре
,
коэффициент
объемного расширения газов (для идеальных
газов
,
).
давление газа при температуре
,
коэффициент
объемного расширения газов (для идеальных
газов
,
).
Графическая зависимость давления от температуры изображается прямой линией – изохорой (рис. 3).
д) Закон Авогадро: при одинаковых давлениях и одинаковых температурах и равных объемах различных идеальных газов содержится одинаковое число молекул; или, что то же самое: при одинаковых давлениях и одинаковых температурах грамм-молекулы различных идеальных газов занимают одинаковые объемы.
Например, при нормальных условиях (t = 0°C и p = 1 атм = 760 мм рт. ст.) грамм-молекулы всех идеальных газов занимают объем 22,414 л. Число молекул, находящихся в 1 см3 идеального газа при нормальных условиях, называется числом Лошмидта; оно равно 2,687*1019> 1/см3
е) Объединенный газовый закон (уравнение Клапейрона):
![]() -
(3.2.5.)
-
(3.2.5.)
- объединение законов Бойля- Мариотта и Гей – Люссака: для данной массы какого-либо идеального газа произведение давления на объем, деленное на термодинамическую температуру, есть величина постоянная.
Газовая
постоянная
![]() зависит от химического состава газа и
пропорционально его массе. Т.к.
зависит от химического состава газа и
пропорционально его массе. Т.к.
![]() ,где
,где
![]() удельный объем газа, то уравнение
Клапейрона можно переписать:
удельный объем газа, то уравнение
Клапейрона можно переписать:
![]() (3.2.5’.)
(3.2.5’.)
- уравнение состояния идеального газа.
где
р,
![]() и
Т - давление,
молярный объем и абсолютная температура
газа, а
и
Т - давление,
молярный объем и абсолютная температура
газа, а
![]() удельная газовая постоянная, зависящая
только от химического состава газа.
удельная газовая постоянная, зависящая
только от химического состава газа.
Запишем
уравнение (3.2.5.) в форме
![]() или
или
![]() ,
(3.2.6.)
,
(3.2.6.)
где
![]() универсальная
(молярная) газовая постоянная, численно
равная работе, совершаемой 1 молем
идеального газа при изобарном нагревании
на один градус:
универсальная
(молярная) газовая постоянная, численно
равная работе, совершаемой 1 молем
идеального газа при изобарном нагревании
на один градус:
![]() .
(3.2.7.)
.
(3.2.7.)
Ее величина найдена экспериментально.
Для
произвольной массы
![]() газа
объем составит
газа
объем составит
![]() и уравнение состояния имеет вид:
и уравнение состояния имеет вид:
![]() ,
(3.2.8.)
,
(3.2.8.)
где
![]() универсальная газовая постоянная,
универсальная газовая постоянная,
![]() масса киломоля газа,
масса киломоля газа,
![]() масса газа.
масса газа.
Это уравнение называется уравнением Менделеева - Клапейрона.
Следствия уравнения Менделеева – Клапейрона:
плотность газа
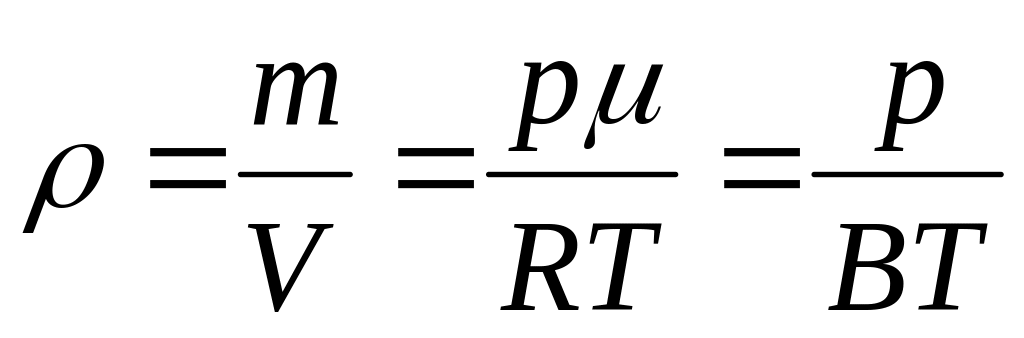 .
(3.2.9.)
.
(3.2.9.)число молекул в единице объема
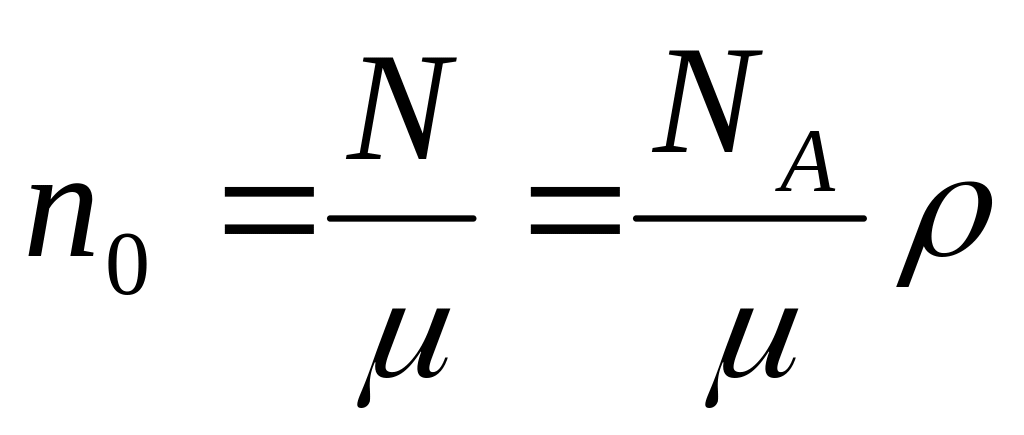 .
(3.2.10.)
.
(3.2.10.)концентрация молекул газа
 .
(3.2.11.)
.
(3.2.11.)
где
k
- постоянная
Больцмана:![]() (3.2.12.)
(3.2.12.)
Уравнение
(3.2.6.) можно записать так:
![]() (3.2.6’.)
(3.2.6’.)
Пример 3.2.1. В баллоне объемом 10 л находится гелий под давлением 10 бар и при температуре 270С. После того, как из баллона было взято 10 г гелия, температура в баллоне понизилась до 170С. Определить давление газа, оставшегося в баллоне.
