
- •Лекция 6.
- •Глава 3. Основы молекулярной физики и термодинамики.
- •§1.Основные понятия.
- •Внешние.
- •Внутренние.
- •§2.Законы идеальных газов.
- •Р Дано: , , , ешение:
- •Р Дано: ешение:
- •Р Дано: , , , , , ешение:
- •Р Дано: , , ешение:
- •§3.Молекулярно-кинетическая теория газов.
- •Распределение частиц во внешних полях.
- •Опытное обоснование молекулярно-кинетической теории.
- •Р Дано: , , , , ешение:
- •Р Дано: ешение:
- •Р Дано: , , ешение:
- •Лекции 7-8.
- •§4.Физические основы термодинамики. Внутренняя энергия системы.
- •Теплообмен. Явления переноса.
- •Вакуум и методы его получения.
- •Работа.
- •Первый закон термодинамики.
- •Р Дано: , , ешение:
- •Решение:
- •Обратимые и необратимые процессы.
- •Энтропия.
- •Круговые процессы. Цикл Карно.
- •Второй закон термодинамики.
- •Третий закон.
- •Р Дано: , , , , ешение:
- •Р Дано: , , , ешение:
- •Решение:
- •Решение:
- •Решение:
- •§5.Реальные газы. Жидкости. Реальные газы.
- •Изотермы реальных газов.
- •Решение:
- •Решение:
- •Решение:
- •Решение:
- •Решение:
Решение:
Расширение
газа здесь является необратимым
процессом. Поэтому нельзя применять
формулу
.
По ней бы мы получили
![]() ,
а по второму закону термодинамики
энтропия газа при его необратимом
расширении должна увеличиваться. Но
т.к. энтропия – функция состояния и ее
изменение полностью определяется
начальным и конечным состояниями
системы, независимо от того процесса,
в ходе которого система перешла из
начального состояния в конечное. Поэтому
представим такой процесс расширения
газа, который переводил бы его в то же
самое конечное состояние, но являлся
бы обратимым процессом и найдем по
формуле
приращение энтропии в таком обратимом
процессе.
,
а по второму закону термодинамики
энтропия газа при его необратимом
расширении должна увеличиваться. Но
т.к. энтропия – функция состояния и ее
изменение полностью определяется
начальным и конечным состояниями
системы, независимо от того процесса,
в ходе которого система перешла из
начального состояния в конечное. Поэтому
представим такой процесс расширения
газа, который переводил бы его в то же
самое конечное состояние, но являлся
бы обратимым процессом и найдем по
формуле
приращение энтропии в таком обратимом
процессе.
Т.к.
данный газ изолирован от окружающей
среды
![]() ,
то его внутренняя энергия по первому
началу термодинамики должна оставаться
постоянной. При этом будет постоянной
и температура расширения идеального
газа во время его расширения, т.е. это
изотермическое расширение
,
то его внутренняя энергия по первому
началу термодинамики должна оставаться
постоянной. При этом будет постоянной
и температура расширения идеального
газа во время его расширения, т.е. это
изотермическое расширение
![]() .
.
Пример 3.4.9. Исходя из второго начала термодинамики, вывести формулу для к.п.д. цикла Карно.
Решение:
Т.к.
цикл Карно – обратимый процесс, то
полное изменение энтропии изолированной
системы нагреватель - рабочее вещество
– холодильник равно нулю:
![]() ,
но полное изменение энтропии складывается
из изменения энтропии нагревателя
,
но полное изменение энтропии складывается
из изменения энтропии нагревателя![]() ,
охладителя
,
охладителя
![]() и
рабочего вещества
и
рабочего вещества![]() :
:
![]() .
Т.к. рабочее вещество, совершив цикл,
вернется в первоначальное состояние,
то
.
Т.к. рабочее вещество, совершив цикл,
вернется в первоначальное состояние,
то
![]() и
и
![]() .
.
![]() ,
где знак минус показывает, что нагреватель
отдает рабочему телу теплоту, переходя
из состояния 1 в состояние 2. Т.к. холодильник
получает тепло, то
,
где знак минус показывает, что нагреватель
отдает рабочему телу теплоту, переходя
из состояния 1 в состояние 2. Т.к. холодильник
получает тепло, то
![]() ,
получим
,
получим
![]() ,
прибавим к обеим частям равенства по
единице
,
прибавим к обеим частям равенства по
единице
![]() .
Получаем
.
Получаем
![]() .
.
§5.Реальные газы. Жидкости. Реальные газы.
В реальных газах молекулы взаимодействуют друг с другом (силы взаимодействия имеют электромагнитную и квантовую природу). Силы взаимодействия зависят от расстояния между молекулами. Силы межмолекулярного притяжения называют ван-дер-ваальсовыми. Типы сил межмолекулярного притяжения:
ориентационные;
индукционные;
дисперсионные.
Уравнение Ван-дер-Ваальса: для киломоля газа
![]() ,
(3.5.1.)
,
(3.5.1.)
для
киломолей газа
![]() ,
(3.5.1’.)
,
(3.5.1’.)
где
![]() и
и
![]() поправки Ван-дер-Ваальса (рассчитанные
на 1 киломоль газа),
поправки Ван-дер-Ваальса (рассчитанные
на 1 киломоль газа),
![]() объем,
занимаемый газом,
объем,
занимаемый газом,
![]() объем
одного киломоля газа,
объем
одного киломоля газа,
![]() число киломолей.
число киломолей.
Изотермы реальных газов.
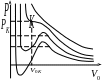
Нанося
графически зависимость
от
![]() из уравнения Ван-дер-Ваальса для различных
из уравнения Ван-дер-Ваальса для различных
![]() ,
мы получим ряд изотерм. Каждая из кривых
соответствует определенной температуре
:
чем выше температура
,
тем правее и выше лежат на рисунке
изотермы. Из рисунка видно, что только
при больших температурах
изотерма
возрастает с уменьшением
монотонно, напоминая изотерму,
соответствующую закону Бойля – Мариотта.
На такой изотерме каждому значению
давления
соответствует одно значение молярного
объема
,
так же как это имеет место при подчинении
газа формуле Менделеева – Клапейрона.
При более низких температурах изотермы
дают в определенной области давлений
и объемов горбы. В этой области, вообще
говоря, каждому давлению
соответствуют три значения объема
.
Область горбов на изотермах относится
к переходу вещества из газообразного
состояния в жидкое и обратно.
,
мы получим ряд изотерм. Каждая из кривых
соответствует определенной температуре
:
чем выше температура
,
тем правее и выше лежат на рисунке
изотермы. Из рисунка видно, что только
при больших температурах
изотерма
возрастает с уменьшением
монотонно, напоминая изотерму,
соответствующую закону Бойля – Мариотта.
На такой изотерме каждому значению
давления
соответствует одно значение молярного
объема
,
так же как это имеет место при подчинении
газа формуле Менделеева – Клапейрона.
При более низких температурах изотермы
дают в определенной области давлений
и объемов горбы. В этой области, вообще
говоря, каждому давлению
соответствуют три значения объема
.
Область горбов на изотермах относится
к переходу вещества из газообразного
состояния в жидкое и обратно.
Критическая изотерма
Критическая точка
Для анализа состояний неоднородных систем в термодинамике вводится понятие фазы.
Опр.3.5.1. Фазой называется совокупность всех частей системы, обладающих одинаковым химическим составом, находящихся в одинаковом состоянии и ограниченных поверхностями раздела.
Типы превращения вещества из одной фазы в другую при изменении внешних условий:
фазовый переход первого рода – выделяется или поглощается теплота (теплота фазового перехода), скачкообразно меняются плотность, удельный и молярный объемы, концентрация компонентов;
фазовый переход второго рода – теплота не выделяется и не поглощается, плотность изменяется непрерывно, скачкообразно изменяется молярная теплоемкость, коэффициент теплового расширения, удельная электрическая проводимость, вязкость и т.д.
Соотношения между параметрами критического состояния и постоянными Ван-дер-Ваальса:
Молярный критический объем газа
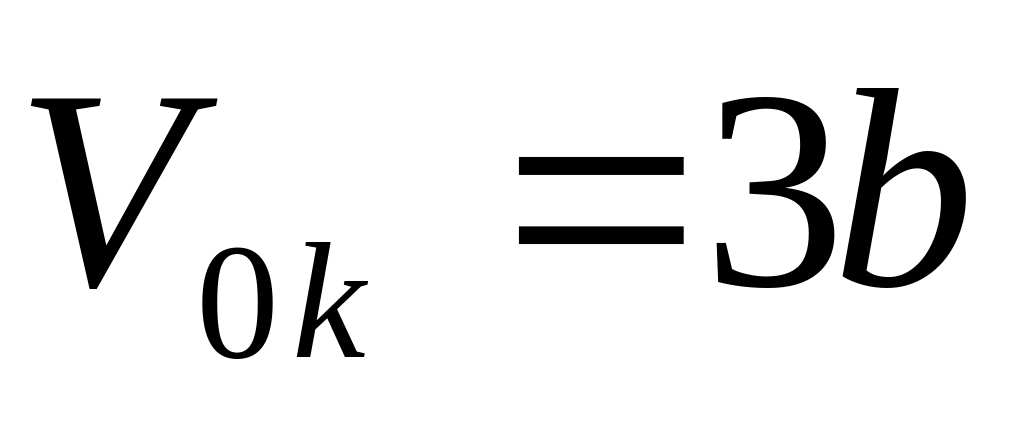 ,
,
Критическое давление газа
 ,
,
Критическая температура газа
 .
.
Коэффициент
поверхностного натяжения измеряется
силой поверхностного натяжения,
действующей на единицу длины любого
контура, лежащего на поверхности
жидкости:
![]() (3.5.2.)
(3.5.2.)
или
поверхностной энергией Е,
которой обладает
каждая единица площади поверхности
жидкости:
![]() .
(3.5.2’.)
.
(3.5.2’.)
Прирост
поверхностной энергии связан с увеличением
поверхности как
![]() .
(3.5.3.)
.
(3.5.3.)
Формула Лапласа: избыточное давление, создаваемое в жидкости вследствие кривизны ее поверхности (поверхностное давление), равно
![]() ,
(3.5.4.)
,
(3.5.4.)
где
![]() и
и
![]() радиусы кривизны двух взаимно
перпендикулярных нормальных сечений
поверхности жидкости.
При этом
радиусы кривизны двух взаимно
перпендикулярных нормальных сечений
поверхности жидкости.
При этом
![]() если поверхность выпуклая,
если поверхность выпуклая,
![]() ,
если вогнутая.
,
если вогнутая.
Формула
Лапласа в
случае сферической поверхности
![]() .
(3.5.5.)
.
(3.5.5.)
Высота
поднятия
жидкости в капилляре радиуса
![]() :
:![]() ,
(3.5.6.)
,
(3.5.6.)
где
![]() плотность
жидкости,
плотность
жидкости,
![]() ускорение
силы тяжести,
ускорение
силы тяжести,
![]() краевой
угол.
краевой
угол.
Высота
поднятия
жидкости в капилляре радиуса
при полном смачивании:
![]() .
(3.5.6’.)
.
(3.5.6’.)
Высота
подъема жидкости между двумя близкими
и параллельным друг другу плоскостями
![]() ,
(3.5.6’’.)
,
(3.5.6’’.)
где расстояние меду плоскостями.
Давление
насыщающего
пара над вогнутой сферической поверхностью
жидкости меньше, а над выпуклой - больше,
чем над плоской поверхностью, на величину
![]() ,
(3.5.7.)
,
(3.5.7.)
где
![]() радиус сферы,
радиус сферы,
![]() плотности
насыщающего пара и жидкости.
плотности
насыщающего пара и жидкости.
Пример
3.5.1. В
баллоне емкостью
![]() находится 0,3 кг кислорода при температуре
270С.
Определить: 1) какую часть объема сосуда
составляет собственный объем молекул
газа; 2) какую часть давления газа на
стенки сосуда составляет внутреннее
давление, обусловленное силами притяжения
молекул.
находится 0,3 кг кислорода при температуре
270С.
Определить: 1) какую часть объема сосуда
составляет собственный объем молекул
газа; 2) какую часть давления газа на
стенки сосуда составляет внутреннее
давление, обусловленное силами притяжения
молекул.
